数字PCR的前世今生:特点、优势和局限性
数字PCR即Digital PCR(dPCR),它是一种核酸分子绝对定量技术。相较于qPCR,数字PCR可让你能够直接数出DNA分子的个数,是对起始样品的绝对定量。
数字PCR是近年来迅速发展起来的一种定量分析技术。该技术结果判定不依赖于扩增曲线的循环阈值(Ct),不受扩增效率的影响,具有很好的准确度和重现性,并且可以实现绝对定量分析。数字PCR已经在核酸检测、鉴定等研究领域显示出巨大的技术优势和应用前景。本推送主要介绍dPCR的历史和发展、dPCR的基本原理和商业化dPCR平台及其特点。
简介
在定量PCR时,我们常常纠结一个问题,究竟是相对定量还是绝对定量呢?如今,你无需纠结了,因为数字PCR(digital PCR)来了。尽管这两种技术有些类似,都是估计起始样品中的核酸量,但它们有一个重要的区别。定量PCR是依靠标准曲线或参照基因来测定核酸量,而数字PCR则让你能够直接数出DNA分子的个数,是对起始样品的绝对定量。因此特别适用于依靠Ct值不能很好分辨的应用领域:拷贝数变异、突变检测、基因相对表达研究(如等位基因不平衡表达)、二代测序结果验证、miRNA表达分析、单细胞基因表达分析等。
dPCR的历史和发展
数字PCR即Digital PCR(dPCR),是一种核酸分子绝对定量技术。相较于qPCR,数字PCR能够直接读出DNA分子的个数,是对起始样品核酸分子的绝对定量。dPCR起源于Cetus Corporation于1988年首次发表的方法,当时研究人员证明可以通过PCR检测和扩增单个β-珠蛋白分子。这是通过将样品分开来完成的,因此某些反应包含该分子,而另一些则不包含。1990年,Peter Simmonds和AJ Brown首次使用此概念对分子进行量化。Alex Morley和Pamela Sykes于1992年正式建立了该方法作为核酸的定量技术。
1999年,Bert Vogelstein创造了“数字PCR”一词,文章正式报道于美国科学院院刊PNAS,并表明该技术可用于发现罕见的癌症突变。作者是美国癌症研究者、霍华德·休斯医学研究所研究员贝尔特·福格尔斯泰因(Bert Vogelstein)。
通过将一个样本分成几十到几万份,分配到不同的反应单元,每个单元至少包含一个拷贝的目标分子( DNA 模板) ,在每个反应单元中分别对目标分子进行PCR 扩增,扩增结束后对各个反应单元的荧光信号进行统计学分析。

文章通过在结肠癌患者粪便中检测KRAS基因突变,并重点突出了dPCR定量检测的能力和潜力(由于PCR是一个指数过程,因此qPCR只能观察到两倍的扩增差异,文章却重点突出了dPCR区别这种微小差异的能力)。但文章仅仅把样本分配到384孔板中,分别用不同荧光检测突变基因和正常基因,通过计算突变基因和正常基因的比例来得出突变率。尽管为了能够提高检测性能需要将样本分配到更多的微孔或液滴中,但基本的思想都离不开Bert Vogelstein所建立的dPCR理念。
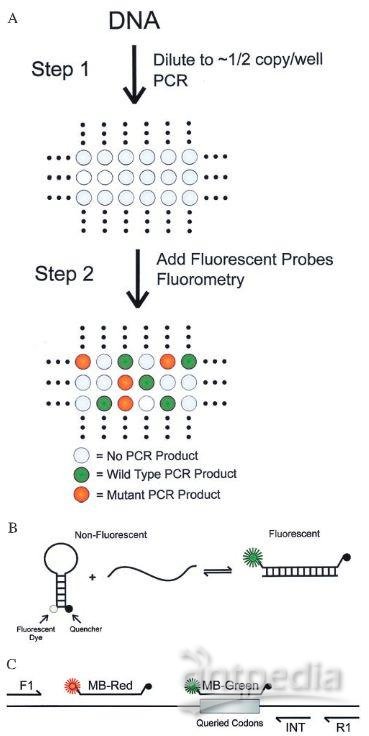
2003年,Kinzler和Vogelstein继续完善dPCR,并创建了一种改进的方法,他们将其称为BEAMing技术,即“珠子,乳状液,扩增和磁性”的首字母缩写。BEAMing技术使用乳状液在单个试管中分隔扩增反应。这一变化能在一次运行中将该PCR扩展到成千上万的反应。

自此,关于dPCR两种形式(芯片式和液滴式)的基本方法都已经建立,dPCR商业化方面,Bio-Rad、LIFE Technologies及RainDance等厂家相继推出技术较为成熟的数字PCR产品。
QuantaLife公司开发出的微滴数字PCR技术。该产品还获得了2011年度Frost & Sullivan北美新产品创新奖。2011年10月,Bio-Rad公司收购了QuantaLife和ddPCR技术,相继推出了QX100、QX200微滴式数字PCR系统。
dPCR的基本原理
目前dPCR主要有两种形式,芯片式和液滴式,但基本原理都是将大量稀释后的核酸溶液分散至芯片的微反应器或微滴中,每个反应器的核酸模板数少于或者等于1个。这样经过PCR循环之后,有一个核酸分子模板的反应器就会给出荧光信号,没有模板的反应器就没有荧光信号。根据相对比例和反应器的体积,就可以推算出原始溶液的核酸浓度。
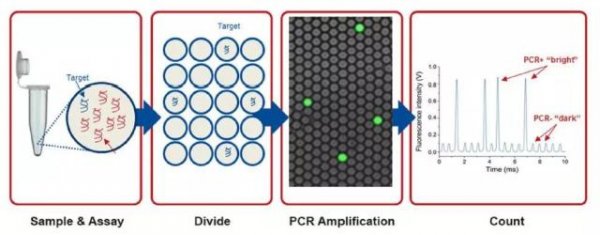
可以使用几种不同的方法来分配样品,包括微孔板,毛细管,油乳剂和带有核酸结合表面的小型化腔室阵列。样品的分配使人们可以通过假设分子种群遵循泊松分布来估计不同分子的数量,根据泊松分布的原理,反应体系中目标分子的拷贝数可以通过公式A=-ln[(N-X)/N]*N计算,从而解决了多个目标分子存在于单个液滴中的可能性。
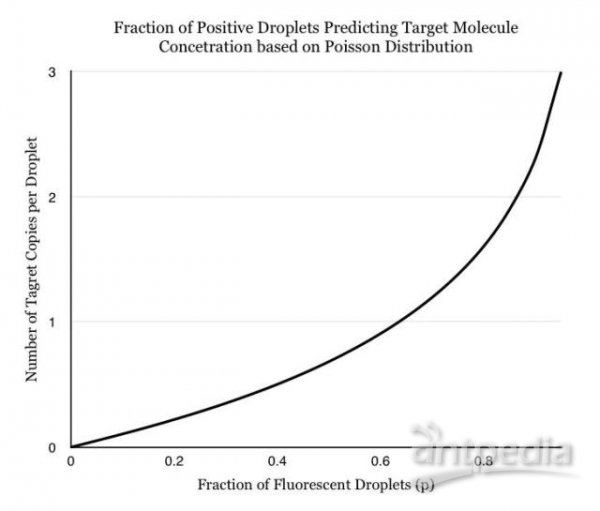
同时,从公式也可以看出,随着反应阳性体系数(X)的增加,体系中目标分子的拷贝数相对于X会有较大的差距,随着X的持续增加,数字PCR结果的不确定度也随着提高,总体来说,数字PCR阳性体系的数量不得超过总体系数量的80%。另一个方面,N的增加会使整个数字PCR体系具有较大的线性范围,并可以提高反应的灵敏度、稳定性以及可重复性。因此,目前dPCR都需要在成本可控的情况下,增加分配的腔室数和液滴数。
商业化dPCR平台及其特点
发展到现在,市面上常见的dPCR主要有两种:微滴式dPCR(droplet dPCR,ddPCR)和芯片式dPCR(chip dPCR,cdPCR)技术。由于芯片式dPCR制造芯片的成本较高,目前微滴式dPCR正越来越受到企业的认可。
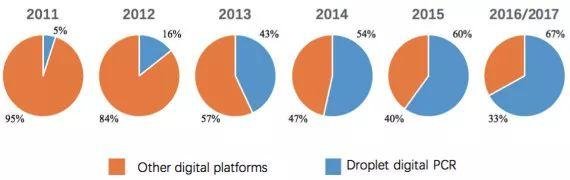
cdPCR(芯片式)主要以Fluidigm公司的BioMark HD系统以及Life Technology公司的QuantStudio 3D系统为代表。Bio Mark系统采用微泵阀式芯片,以聚二甲基硅氧烷为芯片材料,主要依靠微流控通道与阀门的开闭进行原始体系分割,在芯片的反应仓进行PCR反应,然后通过类似于基因芯片的方法扫描每个通孔的荧光信号,进行目的序列含量的计算。QuantStudio 3D系统采用阵列微池式芯片,反应液由进样孔直接进入各微反应池。芯片式dPCR生成微滴体积均一,具有较高的稳定性,体系之间影响较小,但技术操作复杂,通量有限且实验成本较高。

ddPCR(微滴式)主要有Bio-rad公司开发的QX200系统和Rain Drop系统,QX200可以将体系分割成2万个微滴,Rain Drop可以分割成100万-1 000万个微滴。ddPCR原理是通过将一个待分析的PCR反应体系进行微滴化处理,利用微滴发生器制成近20 000个油包水小微滴从而对原始体系进行分割,样品中的核酸分子随机分配到大量独立的微滴中,每个微滴中含有一个或不含待检核酸分子。对微滴体系进行扩增反应以后,分析每个微滴的荧光信号,进行有或无的判断,将判断结果按照泊松分布的原理,通过读取靶标和内参核酸的阳性微滴个数以及比例从而得到靶分子的拷贝数及浓度。与芯片式dPCR相比,操作简单,可以实现高通量的检测,也保证一定程度上的微滴检测稳定性。
Bio-Rad基因表达部门的销售经理Richard Kurtz表示,该公司ddPCR的独特优势是能够产生非常均一、重复的1纳升液滴。这样的好处是每个样品形成20,000个液滴,而其他系统只能分成760-3,000个部分。分得越多,则意味着分析越准确。
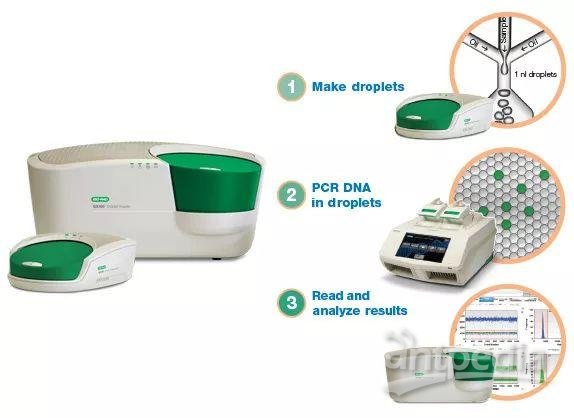
数字PCR的优势
数字PCR是一种核酸分子绝对定量技术。当前核酸分子的定量有三种方法:(1)光度法基于核酸分子的吸光度来定量;(2)实时荧光定量PCR(Real Time PCR)基于Ct值,Ct值就是指可以检测到荧光值对应的循环数;(3)数字PCR是最新的定量技术,基于单分子PCR方法来进行计数的核酸定量,是一种绝对定量的方法。主要采用当前分析化学热门研究领域的微流控或微滴化方法,将大量稀释后的核酸溶液分散至芯片的微反应器或微滴中,每个反应器的核酸模板数少于或者等于1个。这样经过PCR循环之后,有一个核酸分子模板的反应器就会给出荧光信号,没有模板的反应器就没有荧光信号。根据相对比例和反应器的体积,就可以推算出原始溶液的核酸浓度。
与常规的PCR的方法相比,dPCR有很好的优势。
绝对定量
常规PCR和实时荧光PCR定量检测都需要已知拷贝数的标准DNA制定标准曲线,由于样品测定在各种条件上不会完全一致,会造成PCR扩增效率的差异,从而影响定量结果的准确性。而ddPCR不受标准曲线和扩增动力学影响,可以进行绝对定量。
样品需求量低
在检测珍贵样品和样品核酸存在降解时具有明显的优势。
高灵敏度
ddPCR本质上是将一个传统的PCR反应分成了数万个独立的PCR反应,在这些反应中可以精确地检测到很小的目的片段的差异、单拷贝甚至是低浓度混杂样品,且能避免非同源异质双链的形成。
高耐受性
由于目的序列被分配到多个微滴中,显著降低了体系间的影响以及背景序列和抑制物对反应的干扰,扩增基质效应大大减小。
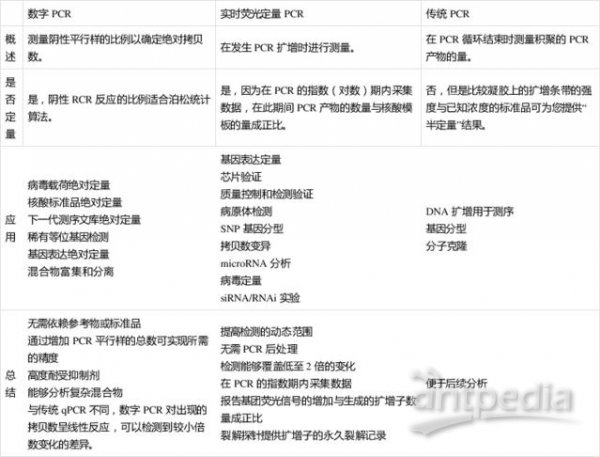
具体每种PCR的对比如下表所示:
于此同时,dPCR也有一些缺点,数字PCR系统成本高,通量有限、操作繁琐等不足。芯片式dPCR由于芯片加工成本高,系统复杂度高,使得商业化优势不是特别明显,特别是目前大多数分子诊断qPCR也能够很好的满足需求,dPCR增加的收益成本比并不算高。液滴式相对芯片式成本有所下降,但典型的液滴式dPCR液滴形成和PCR扩增和检测都分别在不同仪器中完成,增加了很多操作,也增加了系统的复杂性,从这点上看全自动荧光定量PCR做得更好。
小结
尽管dPCR被称作第三代PCR技术,但dPCR技术的广泛应用逐渐显现出一些不足之处。通量不高、操作复杂,同时成本大大增加,dPCR似乎还没有找到相对qPCR足够的不可取代性优势。另一方面,dPCR增加了很多技术难点,如何制作成本低廉的芯片,如何集成液滴生成和PCR扩增,如何进行灵敏的信号检测和分析,如何提高自动化程度,实现Sample-In Result-Out。相较于Digital ELISA能够提高免疫检测的灵敏度到fg/mL级别,实现了高敏蛋白的检测,dPCR尽管发展更早,却难以取得Killer Application,或许这也导致了所谓的第三代PCR在很多人看来却没那么“下一代”。
附:PCR原理
PCR实际上是一个在模板DNA、引物(模板片段两端的已知序列)和四种脱氧核苷酸等存在的情况下,DNA聚合酶依赖的酶促合成反应,扩增的特异性取决于引物与模板DNA的特异结合。























