液相色谱在线净化-电喷雾串联质谱应用(一)
液相色谱在线净化-电喷雾串联质谱测定水产品中大环内酯和林可胺类药物残留
摘 要:建立了水产品中大环内酯类抗生素[红霉素(ERM)、罗红霉素(ROM)、替米卡星(TIL)、泰乐菌素(T Y L ) 、北里霉素(K I T ) 、交沙霉素(JOS)、竹桃霉素(OLM)、螺旋霉素Ⅰ(SPM-Ⅰ)和林可胺类(林可霉素(LIN)和氯林可霉素(CLD))的高效液相色谱-电喷雾串联质谱(LC-ESI-MS/MS)检测方法。样品经提取后、反相液相色谱分离净化后进行质谱分析, 在选择反应监测模式(SRM) 下进行特征母-子离子对信号采集。根据保留时间和母离子及两个特征子离子信息进行定性分析,以基峰离子进行定量。大环内酯类残留的检测限( S/N = 3) 为 0.1-0.2 μg/Kg,定量限为 1.0 μg/Kg,在1.0~200 ng/ mL时峰强度与质量浓度的线性关系良好( R2 > 0.99)。在虾、鳗鱼和带鱼三种基质中1.0、2.0、10.0 μg/kg三个添加水平下, 除个别药物外,药物的平均回收率范围为64 %~114 %,日内相对标准偏差小于11.7 %。结果表明,该法简单、灵敏,特异性强,适用于各种水产品中大环内酯类残留的分析确证。
关键字:大环内酯类药物,水产品,残留,在线净化,LC-MS/MS
1.前言
大环内酯类抗生素(macrolide antibiotics ,MALs)是利用放线杆菌或小单孢菌生产的具有大环状内酯环的抗生素的总称,对革兰氏阳性菌和支原体有较强的抑制能力。林可胺类药物(lincosamides)是具有抗革阳性需氧菌、和革兰阳性或阴性厌氧菌活性的抗生素, 通常用于需氧及厌氧混合感染的治疗。随着更多MALs的出现和商品化,MALs已经广泛用于细菌性和支原体感染的化学治疗[1,2]。林可胺类药物常见的有林可霉素和氯林可霉素,氯林可霉素比林可霉素具有更高的活性。由于食品中的药物或其代谢产物都会有独特的变异性反应,药物在体内蓄积达到一定的浓度,对消费者构成潜在威胁,许多国家对食品大环内酯类药物设定了相应限量要求,要求每种药物的残留限量不超过10μg/kg。目前报道的检测大环内酯类和林可胺类的检测方法主要有高效液相色谱法[3,4]、气/质联用法[2]、液/质联用法(LC/MS)[5-12]。LC/MS是目前药物残留分析中理想方法,它既可用于残留的确证分析,又能作为一种通用的高效能测定方法。有文献报道同时检测蜂蜜中泰乐菌素和林可霉素[13],但国内尚未见液/质联用法测定水产品中大环内酯类和林可胺类药物残留的研究报道。固相萃取方法既可用于复杂样品中微量或痕量目标化合物的提取、又可用于净化、浓缩或富集,是目前兽药残留分析样品前处理中的主流技术。水产品是我国重要的出口农产品之一,也一直是各国对各种药物残留检测的重点产品。水产品的品种很多,实验中选取典型的虾、淡水的鳗鱼和海水的带鱼研究。本实验中对水产品试样用乙腈提取后,浓缩后定容,正己烷脱脂净化,液相色谱在线净化,串联质谱仪测定。方法简单快速,实用性强。
2. 实验部分
2.1试剂和材料
二次去离子水,甲醇(色谱纯),正己烷(色谱纯)。替米卡星、竹桃霉素、红霉素、罗红霉素、泰乐菌素、北里霉素、螺旋霉素Ⅰ、交沙霉素、林可霉素和氯林可霉素标准物:购自sigma或Dr. E公司,纯度≥95%
药物标准储备溶液:1.0 mg/mL。准确称取适量的药物标准物质,用甲醇配成1.0 mg/mL的标准储备液。储备液储存在4℃冰箱中,可使用六个月。
药物标准工作溶液:用空白样品提取液分别配成大环内酯类药物浓度为2 ng/mL 5 ng/mL,10 ng/mL,20 ng/mL,50 ng/mL,100 ng/mL,200 ng/mL标准工作溶液,标准工作溶液在4℃保存,可使用两周。
2.2仪器
液质联用仪由Surveyor液相色谱系统和Thermo Fisher TSQQuantum Ultra 三重四极杆串联质谱[电喷雾电离源( ESI)]构成。液相系统包括自动进样器(Autosampler 1.3),质谱泵(MS Pump 2.0)软件使用Xcalibur 1.4版。真空氮气吹干仪( Zymark 公司,USA),Milli Q去离子水发生器(Millipore 公司,USA)。
2.3试样的制备与保存
2.3.1试样的制备
取具有代表性的可食部分500 g,充分搅碎,混匀,密封,并做上标记,于-18℃冷冻保存。制样过程中,应防止样品收到污染而发生残留物含量的变化。
2.3.2提取
准确称取水产品试样(5.00±0.05g),置于50 mL具塞离心管中,加入10 mL 乙腈,涡旋混匀后,室温下超声10min,加入约5 g无水硫酸钠,涡旋后静置10 min。涡旋静置10min,8000 r/min离心5 min,将上层有机相转移至梨形瓶中。再用10 mL乙腈重复提取一次,合并上层有机相。在40℃下,氮气吹至干。用1.0 mL3:7甲醇水溶液涡旋溶解残渣后再加入和0.5 mL正己烷。溶液涡旋30 s后,16000 r/min离心5 min,取适量下层溶液经0.22 μm滤膜过滤后,供LC-MS/MS法测定
2.3.3测定
液相色谱条件
色谱柱:Varian Polaris C18-A, 5 μm, 150 mm×2.1 mm i.d;流动相:0.1%甲酸水溶液 (A)+甲醇(B);流速:0.25mL/min;梯度:0~3.0 min 10% ~ 60% B, 3.0~4.0 min60% B, 4.0~8.0 min 600% ~ 90% B,8.0~11.0 min 90% B,11.1~13.0 min 10% B;柱温:室温;进样量:25 μL。
串联四极杆质谱条件
离子源:电喷雾离子源;扫描方式:正离子扫描;检测方式:选择反应检测;电喷雾电压:-4500V;雾化气压力:0.060 Mpa;气帘气压力:0.060 Mpa;辅助气流速:5 L/min;离子源温度:350℃;数据采集参数:Scan width: 0.002 amu; Scan time=0.02 s (Ms2)。在线切换阀:0-5.5 min 至废液,5.5-11.0 min 进质谱分析,11.0至废液。
3.结果与讨论
3.1 MS/MS
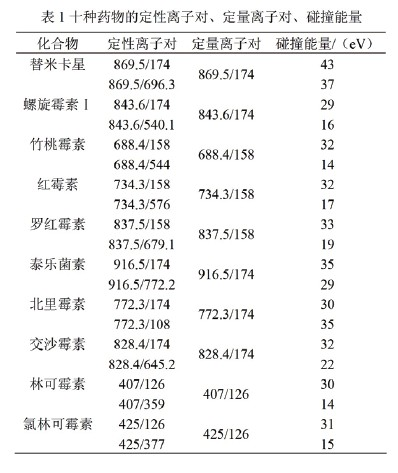
林可胺类的林可霉素和氯林可霉素都有一个共同的m/z126的子离子,质谱裂分机理在文献中已经讨论过。大环内酯类共同的特征子离子为m/z 174或158,两者相差一个氧原子。由于大环内酯类药物在母环上穿在差异,母环相同的竹桃霉素,红霉素和罗红霉素都有m/z158的子离子,另外5种具有相同母环的药物具有m/z174的子离子。根据欧盟EC657指令的规定,对于液-质联用的方法,一个母离子(1.0识别点)加两个特征子离子(2×1.5识别点)可以满足对一个被分析物4个识别点的定性确证的要求。表1列出了八种大环内酯类和两种林可胺类化合物的母离子、子离子及其碰撞能量。
3.2 样品提取
水产品的基质差异比较大,有甲壳类,有淡水的,有海水的。在各种基质中,实验中选取虾作为甲壳类的典型基质,淡水中选取脂肪含量高的鳗鱼作为典型基质,海水中选取带鱼作为典型基质进行加标实验。样品提取中,对于大环内酯类化合物,提取方法主要为有机溶剂提取后,固相萃取净化后再进样分析。通常采用的固相萃取柱的类型为反相的C18或HLB,或者阳离子交换的MCX或SCX。在使用阳离子交换时,需要条件pH至酸性,而酸性条件下一些大环内酯药物如泰乐菌素会分解。实验中比较了HLB和MCX固相萃取柱,HLB柱上,所有的大环内酯类药物的回收都在70%以上。而在阳离子交换柱MCX上,红霉素、北里霉素几乎没有回收,泰乐菌素和螺旋霉素回收率不到30%。而反相机理的HLB柱与色谱分离中C18柱的分离机理相同,主要是去掉不保留的盐,其它低保留的杂质和高保留在柱上用甲醇洗脱不下的非极性杂质。实验中采用乙腈提取后加入无水硫酸钠,乙腈浓缩后,在样品定容时采用正己烷脱脂净化,结合质谱仪器的在线净化,实现样品快速分析。乙腈提取后再加入无水硫酸钠是为了防止无水硫酸钠结块,溶剂不能充分渗透而导致回收率偏低。在样品定容时加入正己烷可以很好的去掉非极性的脂肪等杂质。质谱仪器上的在线切换阀将5.5分钟前所流出的杂质切换至废液中,可以有效的消除盐和低保留杂质对质谱离子源的污染。样品的加标图和标准图相比,几乎没有干扰,与前处理过程中通过HLB固相萃取净化的效果几乎一致。




















