我科学家找到“革兰氏阳性病原菌”七寸
首次揭示能量耦合因子转运蛋白结构
经过近三年的不懈努力,清华大学施一公教授领导的研究团队首次解析了能量耦合因子转运蛋白的三维结构,并阐述了其工作机制。这将有助于研发抗“革兰氏阳性病原菌”药物。
该成果于北京时间4月15日凌晨两点被国际顶级学术期刊英国《自然》杂志在线发表。
能量耦合因子转运蛋白是近几年才成功鉴定的一类转运蛋白,广泛存在于革兰氏阳性病原菌中,负责帮助细胞摄入维生素和其他微量元素。“如果确定这个蛋白的三维结构和工作机制,科学家们就能够靶向设计药物小分子,进而治疗由革兰氏阳性病原菌引致的多种疾病。”论文第一作者、清华大学医学院副研究员王廷亮在接受科技日报记者采访时说。
革兰氏阳性病原菌,作为一类细菌总称,成员众多。其中,金黄葡萄球菌、炭疽杆菌、肺炎双球菌等是这类病菌的代表,可引发局部化脓感染、肺炎、心包炎等多种疾病。
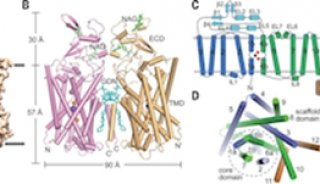
施一公研究组通过X—射线晶体衍射的方法,确定能量耦合因子转运蛋白由4种组分构成:两个亲水蛋白帮助水解ATP并提供能量;膜蛋白EcfS用于识别和转运维生素小分子;膜蛋白EcfT负责传递能量。
这项成果最重大的科学意义在于首次揭示了能量耦合因子转运蛋白的工作机制。研究组发现膜蛋白EcfS与细胞膜基本处于平行状态,而一般膜蛋白基本是垂直于细胞膜。这意味着该蛋白的工作机制,有别于目前转运蛋白通用的“交替通路”模型,是一种颠覆性的、崭新的工作机制。对此,研究人员打了个形象的比喻:“膜蛋白EcfS就像一个酒杯,竖直状态下接受外界维生素小分子,然后在能量传递的作用下翻转把营养分子倒入细胞内。而之前发现一般膜转运蛋白就像一个过道,向外开门的时候摄取细胞所需物质,向内开门的时候给细胞输送各类分子。”