清华颜宁最新Cell Res文章
来自清华大学的研究人员在新研究中结合结构生物学和生物化学方法,系统地研究了PYL13的功能和机制,研究成果在线发表在10月29日的《细胞研究》(Cell Researchz)杂志上。
文章的通讯作者是清华大学的颜宁(Nieng Yan),2007年作为普林斯顿大学博士的颜宁受聘于清华大学医学院,成为清华最年轻的教授、博士生导师。在回国的几年间,颜宁教授研究组主要聚焦于膜蛋白、胆固醇代谢调控通路相关因子的结构生物学研究,在Science、Nature、Cell等杂志上发表多篇重要的论文,并荣获了中国青年女科学家奖、HHMI国际青年科学家奖等奖励。
脱落酸(Abscisic acid,ABA)是植物中最为重要的激素之一,其参与调控植物生长发育的各个阶段,如种子的成熟与休眠、根系发育、叶片枯萎等。作为“逆境激素”,ABA在植物应对各种环境胁迫过程中也发挥着关键作用。在水分胁迫下,植物细胞内ABA的含量迅速增加,迫使气孔关闭并且调控大量相关基因的表达,从而减少干旱或高盐胁迫对植物组织的伤害。
近年来,有关ABA信号转导分子机制的研究越来越多,其中,最为突出进展的则是ABA受体PYR1/PYL/RCAR蛋白家族(PYLs)。在拟南芥中该蛋白家族包含了14个成员,分别命名为RCAR1~RCAR14或PYR1和PYL1~13。在这14个PLYs成员中,PYL13与众不同。它是唯一对ABA无反应的PYL。
序列分析揭示在PYL13中一个谷氨酰胺(Gln)残基取代了ABA敏感PYLs中对于协调ABA至关重要的保守Lys残基。与之相一致,将 PYL2的相应Lys突变为Gln也可完全破坏它对于ABA的亲和力。自发现PYLs是ABA的受体以来,尽管针对各个PYL成员科学家们开展了大量的研究阐析它们的机制。但目前对于PYL13的功能仍不是很清楚。
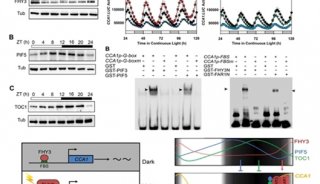
在这篇文章中,研究人员证实PYL13不依赖于ABA,选择性地抑制了PP2CA的磷酸酶活性。他们构建出了分辨率为2.4埃的PYL13- PP2CA复合体晶体结构,阐析了PP2CA和PYL13之间特异识别的分子基础。除了PYLs与PP2Cs之间典型的相互作用,研究人员还发现了一个额外的接触面,在PP2CA中从前未知的CCCH zinc-finger (ZF)模体的附近。序列搜寻发现了另外56个包含ZF的PP2Cs,所有这些都来自于植物。生物化学分析结果表明,PYL13可与PYL10形成异源寡聚体。这两种PYLs在ABA非依赖性抑制PP2Cs作用上相互拮抗。
这些生化和结构研究提供了关于PYL13在植物胁迫反应中功能的新认识,为PYL13的未来生物技术应用奠定了基础。
-
科技前沿
-
科技前沿
-
科技前沿
-
项目成果
-
项目成果
-
项目成果