最新《Nature》技术动态:相互作用组学
1987年,瑞士的研究人员报道了2例来自同一家庭的两姐妹,携带类似的出生缺陷:小脑少一绺组织,且心脏有孔和裂痕(Ritscher–Schinzel综合征)。一位在接受心脏手术后没活过3岁,另一位在4岁接受了类似的心脏手术,存活了下来。
她们的父母并没有携带这些异常,当时的研究人员认为,两位患者一定是继承了2个拷贝的某个非典型基因才生出了以上这些不寻常的症状【1】。某一基因争夺核苷酸的过程应该为女孩的疾病表型负责。
随后,科学家又鉴定出其他一些基因也与Ritscher–Schinzel综合征有关。然而,这些基因的功能以及导致症状的机理多年来仍是个谜。
随着分子生物学研究进入以蛋白质组学为标志的后基因组时代,蛋白质相互作用成为蛋白质组学研究的一个重要主题。
通过映射蛋白之间的连接,三个独立科研小组发现了一个名叫Commander的蛋白质复合体。Commander是一个重要的蛋白质分类和递送蛋白,它的故障是导致Ritscher–Schinzel综合征症状的原因【2】。
事实上,包括蛋白质在内的其他生物分子很少独立工作,在相互作用时它们或是迅速从另一个分子表面擦过,或是牢固地结合在一起形成复杂的细胞机器。分子之间相互作用故障会影响人体健康。
“如果你打断复合体内某个基因编码蛋白,复合体机器的某些方面就会失调,疾病就找上门来,”德州大学Austin分校的系统生物学家Edward Marcotte说。
生化学家一辈子都致力于研究一个或几个蛋白质之间的相互作用。如今,他们联起手来,正在开发一款从细胞器到有机体尺度的“蛋白质相互作用图谱”。
这团乱麻般的点线图包含着与疾病有关的根源线索——关键复合物和共用功能。
过去三年,已有课题组陆续发表了几篇高质量的相互作用组学图谱文章【3、4、5、6】。迄今为止,这张地图已经覆盖了约93000个独一无二的蛋白质-蛋白质相互作用。
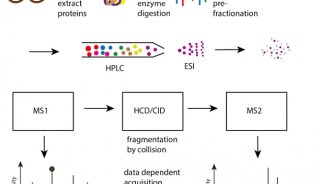
蛋白质相互作用图谱测绘技术可以追溯到1990s。从21世纪初,蛋白质纯化、质谱、基因编辑技术等方法学改进,让科研人员的制图工艺日益精细。
捕获所有相互作用是一项伟大的挑战。因为不同组织、细胞、时间都会造就不同形态的蛋白质组合。相互作用组学是机体反应外界环境的动态分分合合。有效地连线蛋白质不仅需要创新技术,还需要系统生物学的全局思考方式。
选A还是选B
有两种通用的相互作用组图谱绘制方式:第一种酵母双杂交试验,通过偶联基因表达体现细胞内发生直接相互作用的蛋白对;第二种是通过抗体/标签分离纯化复合体,然后用质谱鉴定复合体内部组分,识别直接相互作用或间接相互作用的蛋白质。两种高通量方法各有各的支持者,彼此互补。
Marcotte实验室用的是第二种方法,涉及生化分离蛋白质方法,例如蔗糖密度梯度离心。
“方法再多,相互作用图谱仍不一定完整,”Dana-Farber癌症研究所的计算生物学家Katja Luck说。“人类基因粗略约编码2万种蛋白,假设一种蛋白只具一种构型,大致就会有2亿种相互作用方式。因为许多相互作用可能是间接的,所以实际数量可能远小于这个计算值。但是只算一对一的相互作用种类也有12万到100万种。”
“在生化角度,蛋白质的多样性几乎超乎人类想象,正因如此每次相互作用捕获实验都不一定相同。例如,膜蛋白相互作用研究难点在于一旦从膜上剥离,它们的形状和行为就可能发生改变,与之相连的典型伴侣可能荡然无存。但是,话说回来,目前为止‘不完整的’蛋白质相互作用图谱都还不清晰,”Luck说。“我们还在开门钥匙的寻找阶段,才刚开始了解不同方法的偏好,还没摸到事实真相的门槛。”
酵母双杂实验始于1989年,有关它的实验改进一直在继续。Luck曾在遗传学家Marc Vidal的指导下做博后研究,也参与过酵母双杂的改良工作。“我们做了一些调整,用条形码标记蛋白质编码基因,严格注意细节、自动化的操作和一式四拷贝的测序允许研究人员同时识别超过6万种相互作用,其中大部分都是未知的。”
先进的技术让“人类参考蛋白相互作用图谱计划(Human Reference Protein Interactome Mapping Project)”的点线数量得以持续增长。
“然而工作并非总是一帆风顺,回顾2006年的数据,近十年来只有约3%的相互作用能通过其他方法的验证【7】,”Vidal说。“人们在使用这些数据集时都非常谨慎。”
更好的选择——CRISPR
德国Max Planck研究所的生物化学家Matthias Mann认为借助基因编辑技术,如CRISPR-Cas9的力量来解决蛋白质相互作用图谱的不同版本问题(不同细胞、组织、细胞反应变化版本等)可能是一个乐观的选项。
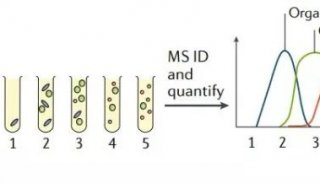
Mann的绘图策略是参考细胞系蛋白质表达数据库,利用超高分辨率质谱仪“轨道阱(Orbitrap)”测试细胞内部上百种蛋白质的相互作用。
将诱饵蛋白与绿色荧光蛋白融合,再通过活细胞成像来量化相互作用。十年前,创建细胞库仍是“相当费力”,但如今,CRISPR工程的强大功能可以负荷这一策略。Nature Methods:蛋白质相互作用高通量筛选新系统
2010年以来,通过引入这种定量法,Mann实验室已经测绘了28000多个相互作用的结合强度。“人类蛋白质相互作用以弱关系为主,我们的研究结果解释了为什么稳定的蛋白质机器大多由‘低峰度蛋白’组成。”
Thermo Fisher Scientific
这一领域的常识是采用相对温和的样品制备操作,目的是忠实地捕获细胞中所有蛋白质-蛋白质相互作用。
“我们正在寻找破坏性更小的实验方法,”总部设在加州圣何塞的Thermo Fisher Scientific生命科学公司的生化学家Rosa Viner说。该公司致力于改进样品制备、操作流程和质谱技术,目的是帮助研究人员识别细胞中的相互作用。
Viner曾与加州大学欧文分校的研究人员开发了“多重、等压标记交联肽定量(quantitation of multiplexed, isobaric-labelled crosslinked peptides,QMIX)”策略,将负责稳固蛋白质的交联化合物打上化学标签,实现蛋白质复合体的有效跟踪【8】。
索取赛默飞世尔有关代谢组学的质谱分析平台详细技术资料请填写联系方式
微调
“当你进行高通量分析时,对单个蛋白质的关注就容易受限,如今的这些高通量分析技术倾向于批量化反应操作,这样就没有多少空间能根据不同情况量身定制,”哈佛医学院的细胞生物学家Wade Harper说。
于是,Harper和同事Steven Gygi创建了一个实验室来专门进行“微调”。一个只有4到6人的小团队,每个月生产400到500株细胞系,他们的献身精神创造了有史以来单一渠道所贡献的最高产的人类蛋白质复合体数据库“BioPlex”,内部包含大约12万个蛋白质相互作用。
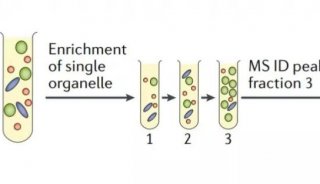
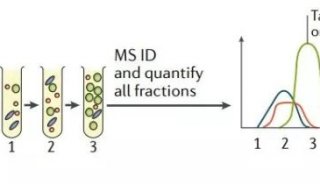
为了更深入地观察相互作用,研究人员必须潜入细胞内拥挤的微观景观。
多伦多大学的生化学家Anne-Claude Gingras采用了“BioID”技术,让目标蛋白给它附近的蛋白加标签,这就像手拿蜡笔走到哪画到哪的小朋友,追寻蜡笔踪迹,就能发现小朋友的运动轨迹。
研究人员由此绘制了初始蛋白的物理邻居图谱,确定蛋白质所在的社区群体,有可能会透露其功能信息。
“我们观察染色质上的蛋白质,绘制中心体组织结构,检测所有跨膜组分的相互作用,”Gingras说。利用BioID,该课题组已经发现了调节器官大小和发育的信号通路新成员【9】。
Harper采用的是类似的方法,他们称其为“APEX”,以抗坏血酸过氧化物酶(一种植物工程酶)限制蛋白标记其他相邻蛋白的时间,虽然生成信号变弱了,但测绘空间更精确。
Howard Hughes医学研究所的细胞生物学家Jennifer Lippincott-Schwartz的实验室开发了一款活细胞蛋白质可视化工具,能看到内质网、高尔基体、溶酶体、过氧化物酶体、脂质滴等6种细胞器的三维移动和相互作用。该团队将依托于该技术的研究称为“细胞器相互作用组学(organelle interactome)【10】”。