研究抗体药物的糖基化修饰为何重要?
在众多的蛋白质翻译后修饰中,糖基化修饰是最重要和最复杂的修饰之一,也是评价抗体的关键质量属性之一。单抗药物功能的实现与其糖基化修饰密切相关,糖基化修饰会影响蛋白的性能,如构象、稳定性、溶解度、药物代谢动力学、活性及免疫原性。本文中,笔者就糖基化及其对抗体药物的稳定性/半衰期、安全性及生物活性进行了简要概述。
糖基化是蛋白质重要的翻译后修饰之一,根据糖基化的修饰位点可将糖基化分为N位糖基化和O位糖基化。N位糖基化位于Asn-297,寡糖中的N-乙酰氨基葡萄糖与天冬酰胺残基上的酰胺氮连接修饰蛋白,起始于内质网完成于高尔基体;O位糖基化由寡糖中的N-乙酰半乳糖与丝氨酸或苏氨酸残基上的羟基连接修饰蛋白,在高尔基体完成。
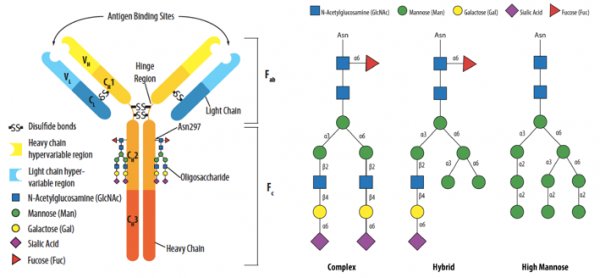
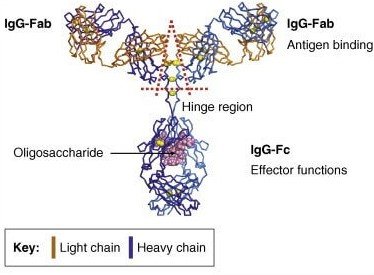
动物细胞分泌的免疫球蛋白中N位的糖基化是最普遍的糖基化修饰,同时也是研究最多的一种糖基化修饰。以IgG1为例,其重要的糖基化修饰位点位于Fc端,且根据其末端精细结构(长度、分支及单糖排列)的不同又可分为复合型、杂合型和高甘露糖型,如图1所示。
图1 单抗中N位糖基化的位置(左)及其三种主要类型(右)
(图表来源于参考文献1)
在图1中可以看到IgG1的糖基化修饰为复合型,其糖基化以岩藻糖(Fuc)为核心,再由N-乙酰氨基葡萄糖(N-GlcNAc)分出两条等长的分支,其分支上伴以甘露糖(Man)、半乳糖(Gal)和唾液酸(Sia),由此构成IgG1的Fc端N位糖基化。根据两条分支中的单糖不同,可将IgG1的糖基化修饰类型分为表1中的不同糖型,正是由其糖型的不同导致单抗的免疫原性、生物活性、药物动力学等的不同。
表1 IgG1的Fc端糖基化修饰类型
注:N-Acetylneuraminicacid,N-乙酰神经氨酸即为唾液酸;
表格来源于参考文献3。
不同的糖基化修饰对抗体的稳定性和半衰期、安全性及生物活性具有不同的影响,下面进行一一叙述。
稳定性和半衰期
蛋白糖基化修饰最明显的作用就是其可以增加蛋白的稳定性及溶解度。有研究表明,糖基化可以通过隐藏蛋白与蛋白酶的结合位点而保护蛋白。Rudd等发现,N-糖基化对邻近多肽的位阻保护是由于糖基化与亲水性氨基酸形成了氢键。糖基化修饰还可以阻碍蛋白酶与抗体的结合,从而增加抗体的稳定性。
糖基化中的唾液酸糖型可以延长血清中的糖蛋白的存在时间。当糖蛋白的糖链在半乳糖修饰终止时或去唾液酸化后,则其便可以被唾液酸糖蛋白受体(ASGPR)识别,从而导致半衰期的大幅减少。位于肝细胞表面的ASGPR不能识别全唾液酸化的糖蛋白,但当其随着血液循环时会被血液中的非特定唾液酸酶去唾液酸化,祼露的半乳糖糖基可以被ASGPR识别,糖蛋白被降解。还有研究称高甘露糖型会降低血清中抗体的半衰期。
Junttila等的研究发现岩藻糖化对IgG1的半衰期具有影响,与正常的曲妥珠单抗相比,岩藻糖化的曲妥珠单抗的药物代谢动力学发生了改变,从而导致其半衰期适度降低。
一般情况下,药物在人体内稳定性越高、半衰期越长,则会发挥更大的效力。就抗肿瘤药物,如果药物稳定性较高、半衰期较长,临床治疗时的给药量可以适当降低、给药间隔也可设计的更长,而达到的效果一样。但随着药物在人体内的稳定性及半衰期增加,由于潜在的脱靶可能,药物的安全性也将成为需要考虑的因素之一。
安全性
抗体的关键质量属性(CQAs)是评判其是否合格的标准,CQAs必须是在一个合适的范围内,以保证药物的有效性,更重要的是药物的安全性。通过影响Fc端的效应功能,Fc端的糖基化修饰会对抗体的安全性造成影响,其表现形式为免疫原性、PK/PD(药物代谢动力学/药物效应动力学)等。
抗体的发展先后经历了鼠原性抗体、嵌合性抗体、人源化抗体,再到最后的全人源抗体,抗体的免疫原性一直在不断的降低。对于糖基化修饰,人体细胞专一性的合成Neu5Ac唾液酸,而其他哺乳动物细胞不仅合成Neu5Ac唾液酸,还可合成对人类具有免疫原性的Neu5Gc唾液酸。抗体生产时常用CHO细胞作为宿主细胞,而CHO细胞通常会高表达唾液酸,并且其中能引起人体免疫反应的Neu5Gc唾液酸的比例最高可达到3%。因此CHO细胞生产抗体时,如果Neu5Gc唾液酸不能安全去除则可能存在引起人体免疫反应的风险。
与唾液酸类似,人类细胞单一的表达β-1,4-半乳糖,而其他哺乳动物细胞还表达对人类具有免疫原性的α-1,3-半乳糖,这种α-1,3-半乳糖修饰为人类异种移植猪器官带来了阻碍。同时,鼠科细胞第NS0和Sp2/0生产的抗体中也可能会有这种半乳糖修饰,这类抗体在使用时应严加控制,将其免疫原性降低在可授受范围内。
抗体已经发展到全人源抗体,由糖基化修饰不同引起的免疫原性应该不再考虑。然而,为了增加抗体的功效或是延长其半衰期,往往会人为的引进某些氨基酸突变、糖基化改动等,进行这样的改动时就需要考虑其潜在的免疫原性。并且,免疫原性不仅仅有内因,外部因素如物料、多聚体的形成、表面活性剂的引入等,均会产生免疫原性。
PK/PD主要考量的是药物在体内作用的最小剂量及存在时间,对于不能完全消除免疫原性的抗体,将免疫原性控制在最低显得尤为重要。糖基化修饰主要通过影响抗体的稳定性及半衰期进而对PK产生影响,此外,糖基化还会影响FcRn与抗体的结合进而影响药物的PK。糖基化对抗体活性的影响作用于PD,这点将在下面的版块中讲到。研究抗体的PK/PD时有时还会引入清除率,与Fc受体结合强的抗体的清除率低,而糖基化会影响抗体与Fc受体或C1q补体的结合强度。如果抗体的清除率低,与Fc受体或C1q补体结合的抗体可能会使免疫系统攻击正常细胞,产生严重的脱靶效应。
生物活性
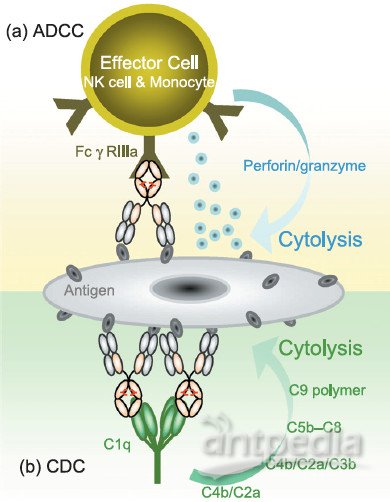
肿瘤治疗中,抗体发挥效力两个重要途径分别为抗体依赖的细胞毒性作用(Antibody-dependent cell-mediated cytotoxicity,ADCC)和补体依赖的细胞毒性作用(Complement-dependent cytotoxicity,CDC),其作用机制如图2所示。
图2 ADCC和CDC作用机制
(图表来源于参考文献2)
抗体的Fc端的糖基化修饰位点通常是Fc受体(ADCC机制)和C1q (CDC机制)的结合位点,通过对糖基化的调整可以增加Fc受体和C1q与抗体的结合,从而增加抗体ADCC和CDC活性。
很多研究中均有报道,唾液酸糖基化修饰会影响抗体与FcγRIIa的结合,从而降低抗体ADCC活性。
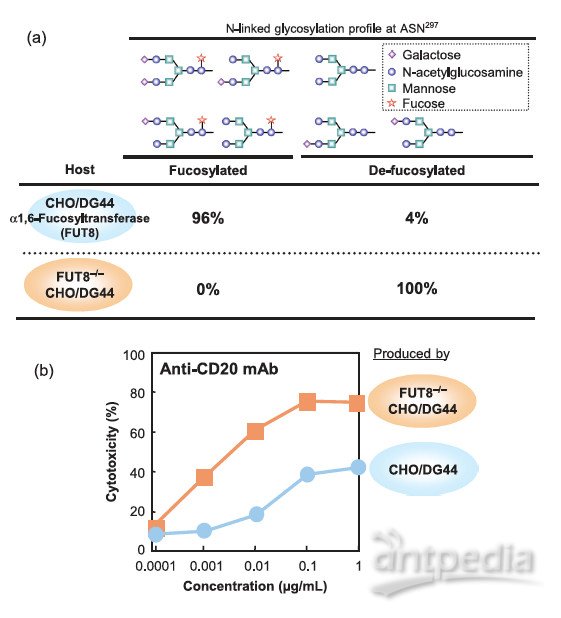
抗体的糖基化修饰中,岩藻糖被认为是影响ADCC活性最重要的单糖,去岩藻糖化可以显著提高抗体与FcγRIIIa的亲和力及ADCC活性(最高达100倍),目前的研究还没有发现岩藻糖化对CDC活性的影响。如图3,Tsuguo Kubota团队通过基因手段将CHO细胞的FUT8基因(编码岩藻糖)敲除,生产不含岩藻糖残基的抗体,发现其ADCC活性明显增强。
图3 抗体的去岩藻糖化及其对ADCC活性的作用
(图表来源于参考文献2)
相关体外研究中表明,半乳糖化可以增加抗体与补体的结合,从而增加抗体的CDC活性。此外,提高半乳糖化可以提高抗体的ADCC活性,但与岩藻糖化相比只是辅助功能,半乳糖化本身对ADCC活性的作用很小,而岩藻糖化是影响ADCC活性的主要因素。
另外,甘露糖化对抗体活性的影响还不是很明确。虽然Yu团队的研究表明高甘露糖型可以明显增加抗体与FcγRIIa的结合而增加ADCC活性,但是高甘露糖型中是不存在岩藻糖化的,所以并不能明确是高甘露糖化或是去岩藻化对ADCC活性的增强作用。
上面讲到了不同的糖基化修饰到抗体活性的影响,那么如果Asn-297位没有糖基化修饰呢?到目前为此,重链上高水平无糖基化修饰的抗体(highlevels of nonglycosylated heavy chain,NGHC)中还没有发现其具有免疫原性,同样也就不具有生物活性。NGHC型抗体完全失去了FcγRIII的结合能力,与C1q的结合能力也降低了10倍,从而导致该类型抗体失去了ADCC和CDC活性。此外,Ha等对比了半糖基化单抗(一条糖链)与完全糖基化单抗(两条糖链)的生物活性,与完全糖基化单抗相比,半糖基化单抗的ADCC和CDC活性均有下降。
构象决定性能。糖基化修饰对抗体药物的稳定性和半衰期、安全性及生物活性的影响是相互交叉的,将抗体的糖基化修饰控制在合适的范围内,使三者达到平衡是最佳选择。