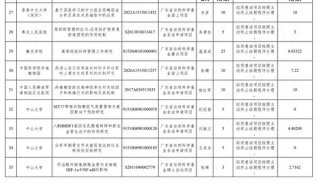
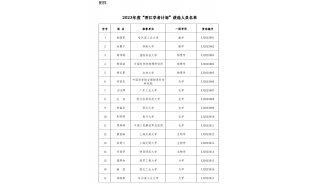
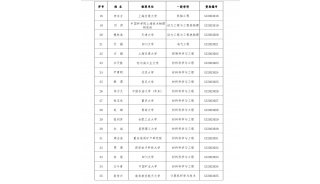
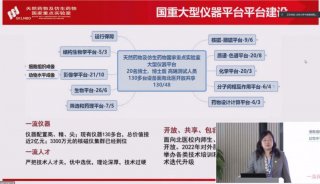
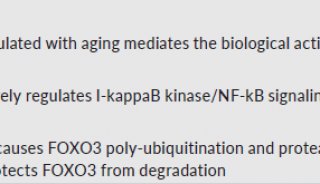中南大学长江学者讲座教授最新Molecular Cell文章
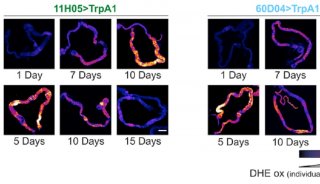
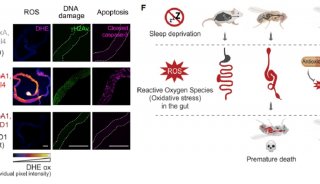
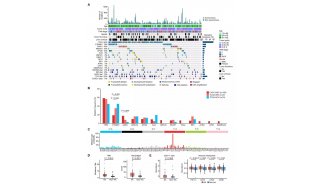
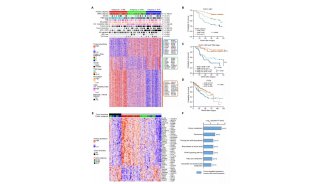
中南大学,美国匹兹堡大学医学院等处的研究人员首次发现了一种新的端粒调控机制,他们利用一种特异的端粒氧化损伤诱导系统,发现有丝分裂基因(NIMA)激酶家族成员Nek7,在端粒出现损伤时,会被召集到端粒附近,稳定TRF1。这项研究推动了端粒的调控机制的探索,为衰老和衰老相关疾病机制的阐述奠定了基础和提供了新的治疗策略。
这一研究成果公布在Molecular Cell杂志上,由中南大学湘雅医院长江学者讲座教授苏冰课题组,美国匹兹堡大学医学院兰莉(Li Lan,音译)教授课题组共同完成,湘雅医院为第一单位,文章的第一作者为苏冰教授实验室的研究生、中南大学湘雅医院博士谭嵘。其他研究人员包括匹兹堡大学医学院院长Arthur S.Levine,中科院国家南方蛋白质研究中心主任雷鸣,以及上海交通大学成员。苏冰教授团队致力于癌症细胞分子信号通路的研究,这是其课题组在基础研究上的又一力作,并得到了国家自然科学基金、NIH(美国国立研究院)等项目的支持。
端粒(telomere)位于染色体的末端,对维护基因组的稳定性至关重要。哺乳动物细胞中,端粒结合因子(telomere repeat binding factor,TRF)在端粒酶阳性和阴性细胞中的定位以及在细胞周期中的表达中扮演着重要的角色。但是端粒结合蛋白如何维持端粒完整性,特别是针对损伤如何做出应答,科学家们仍然知之甚少。
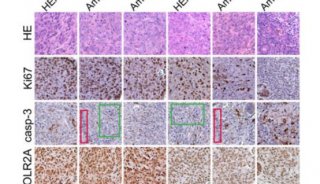
在这篇文章中,研究人员首次发现了一种新的端粒调控机制。他们利用一种特异的端粒氧化损伤诱导系统,发现有丝分裂基因(NIMA)激酶家族成员Nek7,在端粒出现损伤时,会被召集到端粒附近,稳定TRF1。如果Nek7发生缺失,就会导致端粒畸变,过度氧化端粒DNA,增加细胞死亡。在分子机制上,该研究发现Nek7能令TRF1上的Ser114位置磷酸化,并与其相互作用,阻止TRF1与Fbx4(一种Skp1-Cul1-F box E3连接酶亚基)结合,从而减少TRF1的蛋白酶体降解,维持TRF1的稳定。
TRF1的表达和修饰可作为将来衰老损伤以及癌症转化的一个重要指标,TRF1表达水平最高的细胞具有最高的多能性,在应对机体氧化损伤时具有更强大的耐受能,同时也解释了细胞如何在持续积累的氧化代谢中抵抗氧化压力,保持其增殖能力。上述研究成果极大地推动了端粒的调控机制的探索,为衰老和衰老相关疾病机制的阐述奠定了基础,并为该疾病的治疗提供了新策略。
作者简介:
苏冰教授是湖南长沙人,中南大学长江学者、讲座教授,中组部千人计划学者。苏冰教授长期从事细胞生物学和免疫学研究,曾在Cell,Nature Immunology,Nature genetics, Molecular Cell,Immunity等国际著名学术杂志上发表论文80多篇,获得国家自然科学基金,NIH等多项科研资助,其 Screening for modulators of MEKK2 and MEKK3的研究获得了国际ZL。
-
焦点事件

-
政策法规

-
焦点事件

-
焦点事件
-
焦点事件
-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
精英视角
-
焦点事件

-
会议会展

-
项目成果

-
项目成果

-
会议会展

-
项目成果

-
项目成果

-
焦点事件

-
焦点事件

-
项目成果

-
项目成果

-
焦点事件
-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
项目成果

-
焦点事件

-
焦点事件

-
项目成果
-
项目成果
-
项目成果

-
科技前沿
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
科技前沿

-
科技前沿
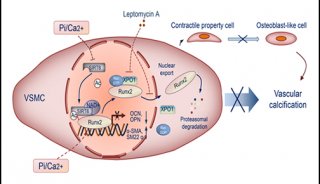
-
会议会展

-
科技前沿
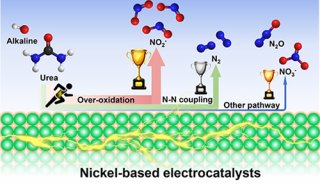
-
科技前沿
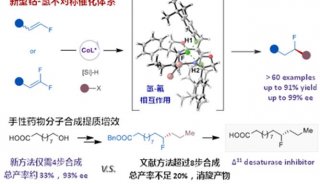
-
科技前沿
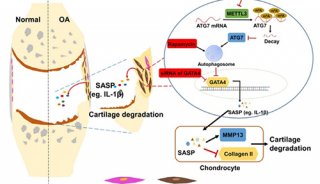
-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
科技前沿
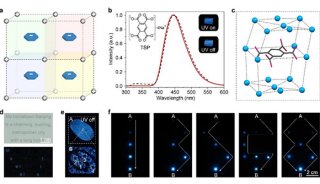
-
科技前沿
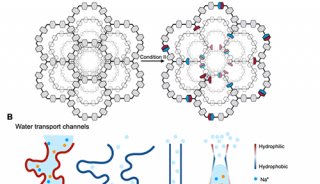
-
焦点事件

-
焦点事件

-
科技前沿

-
科技前沿
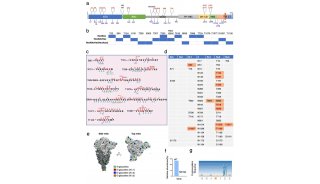
-
科技前沿

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
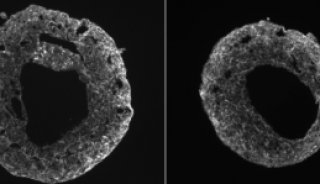
-
焦点事件

-
会议会展

-
技术原理

-
技术原理

-
焦点事件

-
项目成果
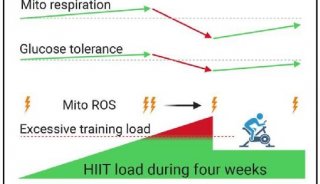
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
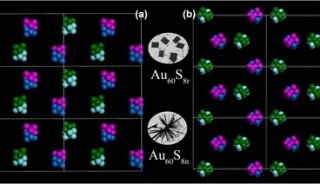
-
焦点事件
-
会议会展
-
项目成果
-
项目成果
-
焦点事件

-
企业风采

-
项目成果
-
焦点事件
-
财报

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件
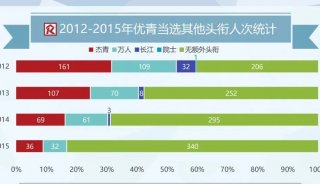
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
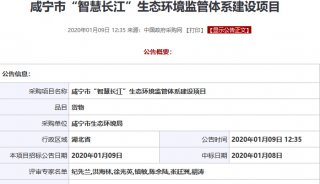
招标采购
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
会议会展

-
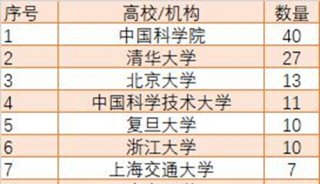
项目成果
-
焦点事件

-
项目成果

-
项目成果

-
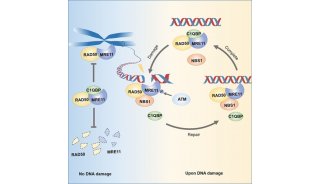
项目成果
-
科技前沿
-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件

-
焦点事件

-
技术原理

-
焦点事件
-
企业风采

-
项目成果

-
焦点事件

-
焦点事件
-
焦点事件