我国学者开发磁介孔二氧化硅纳米粒子治疗肝癌治疗机制
肝癌的发病机制复杂,传统治疗效果不佳且副作用大。而基因治疗具有针对性强、副作用小的优势。因此,基因治疗有希望成为临床上继放疗、化疗之后的又一肝癌治疗手段。在众多基因疗法中,自杀基因/前体药物系统疗法由于其独特的“旁观者效应”最具有临床转化潜能。自杀基因/前体药物系统疗法是通过将自杀基因和前体药物导入肿瘤细胞中,并利用自杀基因编码相关的酶,进而将无毒性的前体药物转化成有毒性的药物,从而杀死肿瘤细胞的癌症治疗策略。然而,自杀基因/前体药物系统疗法的实际应用中,存在着前体药物用量大、自杀基因转染效率低、肿瘤靶向识别性差等缺点,因此开发一种具有生物相容性好、靶向性强、自杀基因和前体药物在细胞内可协同释放、多种治疗方法可联合治疗的多功能纳米载体十分关键。
中国科学院苏州生物医学工程技术研究所研究员董文飞团队与合作者共同开发了磁-介孔二氧化硅纳米粒子为基础的肝癌诊治系统,实现了自杀基因和前体药物在细胞内协同释放、核磁成像介导、磁靶向作用和磁热治疗增强的肝癌自杀基因治疗策略。在有效杀伤肿瘤细胞的同时,降低了自杀基因/前体药物系统治疗方法的副作用,提高了肝癌综合治疗的效果。并通过系统地比较两种不同形貌(核壳与非对称)的磁介孔二氧化硅纳米粒子在载药释药、基因转染、肝癌治疗以及核磁成像上的功效,揭示了非对称磁-介孔二氧化硅纳米粒子在核磁成像引导、磁靶向增强、磁热治疗联合的自杀基因/前体药物肝癌治疗上的优势。
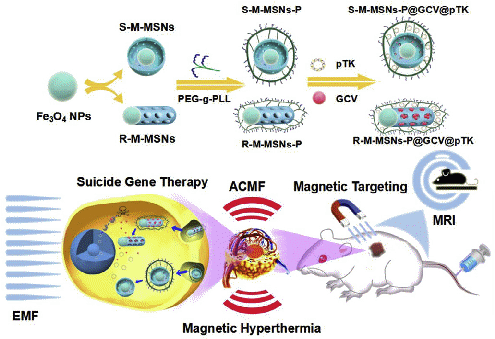
图1为两种不同形貌的磁介孔二氧化硅纳米粒子的合成和在核磁成像引导、磁靶向增强、磁热治疗联合的自杀基因/前体药物肝癌治疗上的应用。
科研人员首先合成了两种不同形貌的磁介孔二氧化硅纳米粒子(M -MSNs),一种为球状的磁介孔二氧化硅纳米粒子(S-M-MSNs),一种为棒状的磁介孔二氧化硅纳米粒子(R-M-MSNs)。随后在M-MSNs介孔内部修饰pH敏感基团,并担载前药GCV。然后在纳米粒子表面修饰PEG-g-PLL多聚物以提高M-MSNs稳定性,并在其表面偶联编码腺苷激酶的质粒,作为自杀基因。科研人员对两种不同形貌的M-MSNs进行了表征,发现两种M-MSNs都表现出了均一的形貌、极好的稳定性、优秀的超顺磁性、极强的药物装载能力和高的基因转染效率。此外,在交变磁场的作用下,两种M-MSNs都展现了高效的磁热转换效应。在细胞水平和动物水平上,基于M-MSNs的自杀基因治疗具有了一定的抗肝癌效果。当与磁靶向作用与磁热治疗联用时,基因治疗的疗效获得了明显的提高。此外,科研人员通过检测小鼠的体重、肝脾肾重量指数以及血清生化学指标和观察组织脏器的结构,发现这种磁介导的自杀基因治疗具有极好的生物安全性。此外,科研人员还揭示了M-MSNs在核磁成像T2加权增强上的功能,证明了其在肝癌诊断治疗一体化的应用潜质。更重要的是,通过系统地比较R-M-MSNs和S-M-MSNs,可以发现R-M-MSNs具有载药能力更强、药物释放更快、基因转染效率更高、磁热转换效率更好的优势,因此在肝癌的治疗上,具有更好的肿瘤抑制作用。综上所述,研究阐明了一种基于M-MSNs的,由核磁成像引导、磁靶向增强、磁热治疗联合的自杀基因/前体药物肝癌治疗新策略。研究成果发表于Biomaterials 154 (2018) 147-157。

图2为两种不同形貌的M-MSNs的表征:(a,c)透射电镜;(b,d)扫描电镜;(e)磁性能表征;(f)介孔性能表征;(g)S-M-MSNs和(h)R-M-MSNs的粒径分布。结果表明,两种M-MSNs均具有均一的形貌,较好的分散性,优异的超顺磁性和介孔性质。其中,R-M-MSNs的磁性能优于S-M-MSNs。

图3为不同浓度的S-M-MSNs与R-M-MSNs的核磁成像效果;(b)不同浓度的S-M-MSNs与R-M-MSNs的横向弛豫效率;裸鼠尾静脉注射(c)S-M-MSNs与(d)R-M-MSNs在有无外加磁场作用下的核磁成像效果;(e)S-M-MSNs与R-M-MSNs在肿瘤组织以及心肝脾肺肾的生物分布。结果表明,R-M-MSNs具有比S-M-MSNs更好的MRI性质。两种M-MSNs经静脉给药后,都可以通过EPR效应,积累在肿瘤部位。且磁靶向作用可以进一步增强M-MSNs在肿瘤部位的积累。相比于S-M-MSNs-P@GCV, R-M-MSNs-P@GCV在肿瘤部位的积累效率更高。

图4为两种M-MSNs@-P@GCV@pTK的肝癌治疗效果。(a)肿瘤照片(b)肿瘤生长曲线(c)肿瘤重量(d)治疗一周和两周后的裸鼠的核磁成像图。结果表明,两种M-MSNs@-P@GCV@pTK都表现出了极好的自杀基因治疗效果。在磁靶向作用和磁热治疗的增强下,两种M-MSNs@-P@GCV@pTK都获得了明显地提升。其中,R-M-MSNs@-P@GCV@pTK的肿瘤抑制作用优于S-M-MSNs@-P@GCV@pTK的肝癌治疗。此外,可以通过MRI对疗效进行无创评价。







