解析在克罗恩病中硒缺乏导致T细胞分化紊乱的机制
炎症性肠病 (Inflammatory bowel disease, IBD) 是一种主要累及胃肠道的的慢性非特异性炎症性疾病,主要包括两个临床亚型,即克罗恩病 (Crohn’s disease, CD) 和溃疡性结肠炎 (Ulcerative colitis, UC)。IBD是西方国家常见的消化系统疾病,近年来在发展中国家的发病率呈快速增长的趋势,预计到2025年我国IBD患者数目将达到150万以上【1】。IBD是一种慢性终身性疾病,青少年好发,需要长期治疗,有多种不良预后,极大增加社会经济负担。
IBD是多基因、多因素参与的复杂性疾病,其发病机制尚未完全明确,免疫应答失调被认为是IBD的发病过程中的中心环节,目前的治疗靶点90%均为靶向异常的免疫应答【2】。过去的研究多采用不同药物治疗后患者的样本进行研究,对疾病早期未治疗时的CD或UC患者的肠道免疫细胞的特征性功能或表达谱仍缺乏系统性研究,如这两类肠病中免疫细胞亚群有哪些差异,是否存在新型的病理特异性的亚群,它们特异性的诱导产生机制是什么,这些问题都尚未充分研究。T细胞的功能失衡是IBD重要的致病因素之一【3】。既往研究表明CD和UC患者T细胞应答模式存在差异【4,5】,可能涉及不同的生物学机制,我们对此的认识仍十分有限。
新兴工业化国家 IBD 发病率的上升可能与城市化进程和饮食结构变化有关【6】,这提示我们肠道局部的代谢改变可能与IBD发病有关。已有研究表明,短链脂肪酸、色氨酸和胆汁酸等代谢物参与粘膜免疫稳态和 IBD 的发病【7】。T细胞的分化及功能受到多种因素的调控,包括细胞因子、趋化因子、肠道中的微生物等。最新的研究表明,代谢物质及代谢过程中产生的活性氧 (Reactive Oxygen Species, ROS) 在T细胞的活化、增殖和分化过程中也发挥着重要的作用。硒是人体必需的的一种微量元素,多种硒蛋白如谷胱甘肽过氧化物酶 (Glutathione peroxidase, GPXs)、硫氧还蛋白还原酶(Thioredoxin reductase,TrxRs) 参与了ROS清除及氧化还原代谢过程。一些研究曾报道了IBD病人体内硒水平较健康人降低,且在动物肠炎模型中硒缺乏可加重肠道炎症【8,9】。然而,硒蛋白如何调控IBD炎症状态下的T细胞功能仍有待探索。
2021年8月2日,浙江大学生命科学研究院靳津课题组和浙江大学医学院附属邵逸夫医院曹倩课题组合作在Immunity发表题为Multiomic analyses reveal a critical role of selenium in controlling T cell differentiation in Crohn’s disease的文章。该合作团队首先利用单细胞转录组测序和代谢组解析了初诊未治疗IBD患者的结肠免疫细胞图谱和代谢微环境特征,发现CD或UC中存在疾病特异性的免疫细胞亚群和代谢物改变。通过体外实验对代谢物的功能进行筛选,发现了可以调控特定疾病中T细胞亚群分化的代谢物,特别是CD患者结肠中特异性减少的含硒代谢物可以调控CD中独特的一群Th1-like细胞的分化。体内体外研究证实了补充硒可以有效抑制Th1的分化,促进肠道炎症的缓解。硒元素主要通过硒蛋白W (Selenoprotein W, SELW) 调控一碳代谢和嘌呤补救途径介导活性氧 (Reactive Oxygen Species, ROS) 清除,从而影响Th1细胞的分化。

图1 工作模型
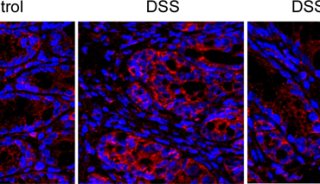
首先,为了分析比较初诊未治疗时CD和UC患者肠道免疫应答模式的差异,作者收集了健康人 (n=3),CD(n=6),UC(n=6) 患者的结肠活检组织,消化分选CD45阳性免疫细胞进行单细胞转录组测序,经数据分析后共获得36个免疫细胞亚群。作者发现CD患者结肠中存在一群独特的类似Th1 (Th1-like) 的细胞,而UC患者中存在一群Th17样细胞 (Th17-like)。先天免疫细胞来源的细胞因子可以调控T细胞的分化,为了阐明两类疾病中产生这两群独特细胞亚群的机制,作者首先比较了两类疾病中的先天免疫细胞的应答模式,然而调控Th1分化或Th17分化的细胞因子在这两类疾病的先天免疫细胞中的表达没有显著的差异。有意思的是,作者发现这两个T细胞亚群的存在多个代谢酶表达差异,提示两者代谢模式不同代谢微环境可能在塑造两类疾病T细胞免疫应答过程中发挥着重要的作用。因此,该研究团队进一步对健康志愿者、活动期CD和UC患者结肠组织进行非靶向代谢组检测,分别鉴定出了92种和275种在CD和UC中特异性变化的代谢物。为了进一步明确这些代谢物是否调控T细胞的分化,作者进行了体外功能筛选实验,鉴定出了一些可以调控特定疾病亚型中T细胞亚群分化的代谢物。
值得注意的是,一种含硒代谢物在CD病人的结肠组织中特异性下调,而且CD患者血清中硒水平也与疾病的活动度呈负相关。体外分化实验显示,补充硒可以明显抑制Th1的分化,而不影响Th17的极化。为了阐明硒调控T细胞分化的机制,作者进一步通过转录组、代谢组、代谢流、流式等技术对补硒处理的Th1细胞和对照组Th1细胞进行了分析,发现调控Th1分化的关键转录因子未受明显影响,而硒处理后Th1细胞中嘌呤合成补救途径中的关键酶及代谢中间产物显著升高,一碳代谢叶酸循环中的关键酶及代谢物显著下调。T细胞的激活需要合成大量的嘌呤用于核酸合成、细胞信号传导和代谢调节【10】,嘌呤主要通过两种途径产生:从头合成和补救途径。该研究显示在Th1分化过程中,硒处理可以抑制一碳代谢导致嘌呤从头合成减少,补救途径代偿性上调。T细胞的活化和分化过程同时伴随着ROS的产生,细胞内ROS水平受到抗氧化酶和其他分子的严格调控。深入的机制研究显示,在Th1细胞中,硒主要通过硒蛋白W (Selenoprotein W, SELW) 调控一碳代谢和嘌呤补救途径介导细胞质中的活性氧(Reactive Oxygen Species, ROS) 清除,从而影响NF-κB信号通路的活化,抑制IFN-γ的产生。在缺硒小鼠中建立T细胞过继转移肠炎模型,补充硒制剂后可以显著减轻肠炎症状,减少结肠固有层中的Th1细胞。临床研究也显示补充硒可以促进缺硒克罗恩病患者症状的改善和结肠黏膜的愈合。
该研究系统解析了初诊CD和UC的肠道免疫细胞组成及代谢改变,阐明了CD结肠中独特的代谢改变塑造局部黏膜免疫应答模式的机制。补充硒制剂有望通过抑制Th1细胞分化来促进CD肠道炎症的缓解。这项工作为深入研究IBD免疫-代谢机制提供了一种新思路,对于全面理解CD和UC的发病机制差异、开发靶向特定疾病的治疗策略有重要的科学意义和临床价值。
浙江大学医学院附属邵逸夫医院消化内科双聘教授、浙江大学生命科学研究院资深研究员靳津教授和浙江大学医学院附属邵逸夫医院消化内科主任、炎症性肠病中心曹倩教授是本文的共同通讯作者,博士研究生黄灵洁、毛信韬和东南大学副研究员李异媛为本文的共同第一作者。
参考文献
1.
Kaplan, G.G. (2015). The global burden of IBD: From 2015 to 2025. Nat. Rev. Gastroenterol. Hepatol. 12, 720–727.
2.
Bilsborough, J., Targan, S.R., and Snapper, S.B. (2016). Therapeutic Targets in Inflammatory Bowel Disease: Current and Future. Am. J. Gastroenterol. Suppl. 3, 27–37.
3.
Xavier, R.J., and Podolsky, D.K. (2007). Unravelling the pathogenesis of inflammatory bowel disease. Nature 448, 427–434.
4. Strober, W., and Fuss, I.J. (2011). Proinflammatory cytokines in the pathogenesis of inflammatory bowel diseases. Gastroenterology.
5.
Rosen, M.J., Karns, R., Vallance, J.E., Bezold, R., Waddell, A., Collins, M.H., Haberman, Y., Minar, P., Baldassano, R.N., Hyams, J.S., et al. (2017). Mucosal Expression of Type 2 and Type 17 Immune Response Genes Distinguishes Ulcerative Colitis From Colon-Only Crohn’s Disease in Treatment-Naive Pediatric Patients. Gastroenterology 152, 1345-1357.e7.
6.
Zuo, T., Kamm, M.A., Colombel, J.F., and Ng, S.C. (2018). Urbanization and the gut microbiota in health and inflammatory bowel disease. Nat. Rev. Gastroenterol. Hepatol. 15, 440–452.
7.
Franzosa, E.A., Sirota-Madi, A., Avila-Pacheco, J., Fornelos, N., Haiser, H.J., Reinker, S., Vatanen, T., Hall, A.B., Mallick, H., McIver, L.J., et al. (2019). Gut microbiome structure and metabolic activity in inflammatory bowel disease. Nat. Microbiol. 4, 293–305.
8.
Barrett, C.W., Reddy, V.K., Short, S.P., Motley, A.K., Lintel, M.K., Bradley, A.M., Freeman, T., Vallance, J., Ning, W., Parang, B., et al. (2015). Selenoprotein P influences colitis-induced tumorigenesis by mediating stemness and oxidative damage. J. Clin. Invest. 125, 2646–2660.
9.
Hinks, L.J., Inwards, K.D., Lloyd, B., and Clayton, B. (1988). Reduced concentrations of selenium in mild Crohn’s disease. J. Clin. Pathol. 41, 198–201.
10. LINDEN, J., KOCH-NOLTE, F. & DAHL, G. 2019. Purine Release, Metabolism, and Signaling in the Inflammatory Response. Annual Review of Immunology, 37, 325-347.
-
科技前沿
-
科技前沿
-
焦点事件
-
项目成果