ACS Catalysis:人工固碳循环研究取得进展
工业快速发展导致二氧化碳等温室气体排放不断增加,促使各国加速开发二氧化碳捕集利用技术。其中,设计和创建具有高效生物固碳能力的酶、生化途径、工程生物或微生物组,已成为合成生物固碳领域的研究热点。
自然界中,植物和微生物可利用六条天然固碳途径将二氧化碳转化为有机物,其中重要途径之一就是以1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)为核心固碳酶的卡尔文循环。为突破天然固碳途径的低效率,2016年和2021年,Science杂志先后报道了人工设计的非天然固碳途径CETCH循环(由德国马普陆地微生物研究所完成)和ASAP途径(由中科院天津工业生物技术研究所完成),可在无细胞系统中将二氧化碳分别转化为乙醛酸和淀粉。这些天然和人工固碳途径较长,一般包含十步以上的生化反应。一般情况下,生化途径的反应步骤越多,整体效率越低。然而,生物固碳途径必须由很多反应步骤组成吗?能否设计一条比天然固碳途径反应数更少的人工固碳途径?如果可以,这样的人工固碳途径需要在怎样的条件下运转,能够达到多高的固碳效率?
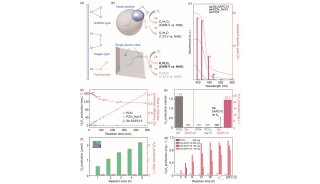
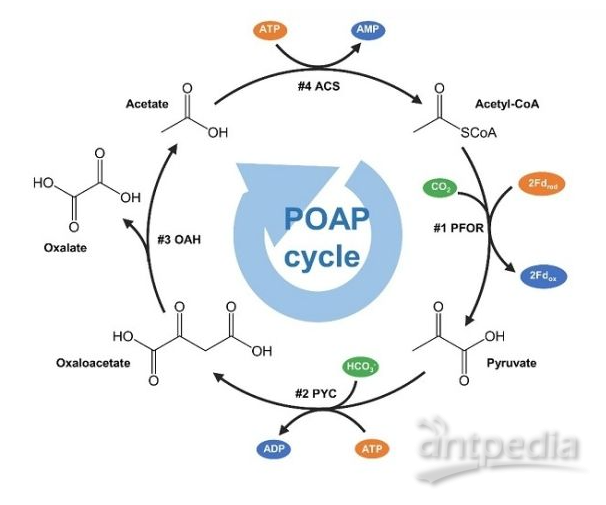
围绕上述问题,中国科学院微生物研究所研究人员基于生化反应热力学和动力学计算,设计出新的最小化的人工固碳循环。该循环包含四步反应,分别由丙酮酸羧化酶(PYC)、草酰乙酸乙酰基水解酶(OAH)、乙酸-CoA连接酶(ACS)和丙酮酸合酶(PFOR)催化,被命名为POAP循环(如图)。在四步反应中,由丙酮酸合酶和丙酮酸羧化酶催化的两步反应均为固碳反应。POAP循环每运行一轮,可以转化两分子二氧化碳生成一分子草酸,消耗两分子ATP和一分子还原力。
在POAP循环的四步反应中,关键且较难实现的是由丙酮酸合酶(PFOR)催化的还原羧化反应。正常情况下,在生物体内能够观察到的反应是PFOR催化丙酮酸氧化脱羧并释放二氧化碳。而实现POAP循环,需要把PFOR催化的氧化脱羧反应逆转过来,即催化乙酰辅酶A还原羧化生成丙酮酸。该还原羧化反应在热力学上不利,需要较大的还原力来推动反应发生。因此,研究人员考虑在厌氧条件下利用低电势的电子供体提供足够的还原力来驱动反应。通过合成并测试一系列低电势的电子供体铁氧还蛋白(Ferredoxin,Fd),研究人员发现来源于Hydrogenobacter thermophiles的Fd2对PFOR的还原羧化反应具有较强的推动作用。以Fd2作为电子供体,可以驱动热纤梭菌(Clostridium thermocellum)来源的异型四聚体丙酮酸合酶实现乙酰辅酶A的还原羧化,这也是异型四聚体的丙酮酸合酶首次在体外实现还原羧化反应。通过进一步合成测试,研究人员获得了构建POAP循环所需要的其他三个酶PYC、OAH和ACS,采用先分别构建POAP半循环、再将两个POAP半循环整合在一起的策略,构建了具有功能的POAP循环。以13C标记的碳酸氢钠为底物进行测试,检测到POAP循环的产物13C标记的草酸,并测定出POAP循环的二氧化碳固定速率为8.0 ± 1.8 nmol CO2/min/mg固碳酶,草酸的转换数为5 摩尔/摩尔POAP循环酶,固碳效率较高。
理论上,构成一个最小固碳循环需要三步反应。POAP循环只含有四步反应,接近理论最小值,是目前经过实验证实的最小化的人工固碳循环。由于途径短,在PFOR活性远低于CETCH循环固碳酶活性的情况下,POAP循环的二氧化碳固定速率仍超过了含有十二步反应的CETCH循环。POAP循环可以在厌氧和较高温度(50°C)下实现二氧化碳固定,为了解和研究地球早期生物如何进行二氧化碳固定提供了新模型,并为二氧化碳的人工生物转化提供了新的可选途径。