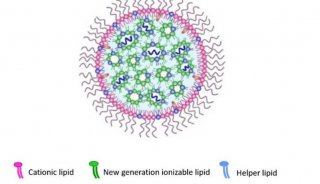
ACS Nano:开发基于液态金属纳米平台的自体癌症疫苗
几十年来,治疗性癌症疫苗(TCVs)经历了复苏。与保护易感人群免受某些病毒病因(如乙型肝炎病毒(HBV)和人乳头瘤病毒(HPV))威胁的传统预防性癌症疫苗不同,TCVs作为主动免疫治疗旨在刺激宿主适应性免疫,以诱导恶性肿瘤消退、减少转移性肿瘤和根除微小残留肿瘤。
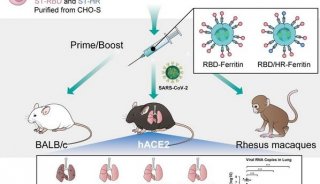
2023年5月30日,中国科学院理化技术研究所饶伟、刘静及北京中医药大学周天团队在ACS Nano(IF=18)在线发表题为 “Liquid Metal Nanoplatform Based Autologous Cancer Vaccines” 的论文,该研究报道了基于液态金属纳米平台的自体癌症疫苗。
尽管做出了广泛努力,但美国食品和药物管理局仅批准了一种基于自体体外树突状细胞(DCs)的治疗性癌症疫苗sipuleucel-T,而其临床疗效并不令人满意。有几个主要障碍阻碍了TCVs通过传统方法的发展,例如(i)肿瘤异质性(患者之间的肿瘤抗原多种多样,难以筛选出最佳的免疫显性肿瘤抗原),(ii)抗原利用无效(快速清除和低效的细胞内化,不足以引发强大的免疫反应),(iii)免疫抑制肿瘤微环境(TME)(肿瘤细胞通过失调、失活和劫持宿主免疫系统来逃避免疫监视,例如程序性死亡-1/程序性死亡配体1(PD-1/PD-L1)相互作用)。
为了应对这些挑战,将自体肿瘤抗原(来源于死亡肿瘤细胞,覆盖整个免疫原表位)转化为疫苗(满足疫苗的基本要求)的原位癌症疫苗(ISCVs)已成为一种有希望的策略,为个性化TCVs提供替代方法。如今,随着(i)局部消融疗法(例如,光疗、放疗和冷冻消融以释放肿瘤抗原,包括肿瘤相关抗原、肿瘤特异性抗原甚至患者特异性新抗原)的创新,ISCVs令人印象深刻的前沿进展见证了人们对TCVs开发的兴趣激增,(ii)纳米生物技术(例如,用于精确抗原和佐剂递送的纳米生物材料),以及(iii)免疫疗法(例如,免疫检查点抑制以缓解免疫抑制)。
一种具有自体抗原吸附性和刺激释放载体偶联功能的多能平台,具有免疫佐剂能力,可以结合消融疗法和纳米递送进行免疫治疗,有望开发个性化TCVs。在这里,研究者提出了一种使用镓(Ga,熔点~29.8 °C)基液态金属(LM,定义为熔点低于或接近室温的金属或合金)纳米颗粒(Ga NPs)进行个性化ISCVs的前瞻性策略,这对于取代其他无机NPs以提高抗原利用率和DCs活化以及避免长期毒性和副作用具有重要意义。
特别地,Ga NPs作为非凡的功能性生物材料表现出良好的光热/光动力性能,这使它们有可能有效地将近红外激光能量转化为热和活性氧(ROS),用于局部破坏原发性肿瘤,从而原位产生肿瘤衍生蛋白抗原(TDPAs),以及昂贵的生产工艺。光热/光动力疗法(PTT/PDT)诱导的局部炎症可以促进DCs的主动募集和细胞摄取。
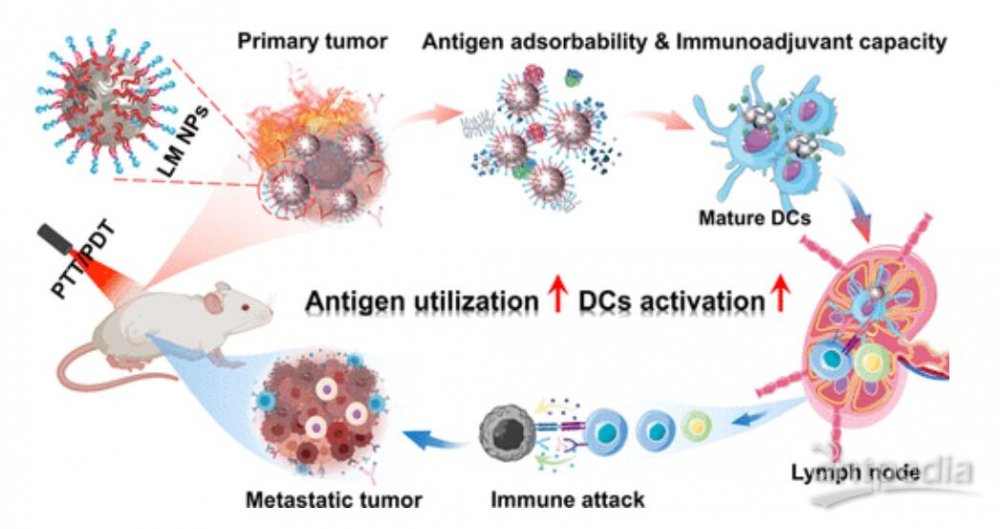
文章模式图(图源自ACS Nano )
受这些有趣特征的启发,研究者通过将1,2-二硬脂酰基-sn-甘油-3-磷酸乙酰胺-N-[马来酰亚胺(聚乙二醇)-2000](DSPE-PEG2000-Mal)自组装到Ga NPs(表示为DPMG NPs)上,构建了一个光触发抗原捕获和免疫刺激的LM纳米平台。特别地,Ga核提供了固有的变形性、生物降解性、光热/光动力性能、抗原吸附性和免疫刺激特性,以产生大量高质量抗原,提高抗原利用率,增加DCs活化,并调节TME,而表面修饰的DSPE-PEG2000-Mal有助于稳定特定结构,赋予了良好的水分散性,增强了抗原的吸附能力。
结合免疫检查点抑制剂(anti-PD-L1),研究者评估了DPMG NP诱导的ISCVs对转移性乳腺癌症模型的原位/脱落抗癌作用和肿瘤预防作用。由于LM诱导的光热/光动力和免疫协同效应,本研究中的治疗策略显示出“自体癌症疫苗”样的机制,它不仅解决了单一治疗不足以完全消除局部肿瘤的缺陷,而且诱导了持久而稳健的肿瘤特异性免疫反应来抑制肿瘤复发和转移。