2019年8月CRISPR/Cas最新研究进展
基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。
图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的8月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Science:重大突破!CRISPR-Cas系统新用途!开发出可编程的CRISPR反应性智能材料
doi:10.1126/science.aaw5122; doi:10.1126/science.aay4198
CRISPR-Cas系统已成为科学家们在不断增加的有机体中研究基因的首选工具,并且正被用于开发潜在地校正基因组中单个核苷酸位点上的缺陷的新型基因疗法。它也被用于正在进行的诊断方法中,用于检测患者体内的病原体和致病突变。
如今,在一项新的研究中,来自美国哈佛大学威斯生物启发工程研究所和麻省理工学院的研究人员展示了将CRISPR用作新型刺激反应性“智能(smart)”材料的控制元件。一旦被特定的天然的或用户定义的DNA刺激物激活,一种CRISPR-Cas酶就能够让多种智能材料释放出自身结合的货物,比如染料和活性酶,改变它们的结构来部署包埋的纳米颗粒和活细胞,或者调节电路从而将生物信号转化为电信号。相关研究结果发表在2019年8月23日的Science期刊上,论文标题为“Programmable CRISPR-responsive smart materials”。
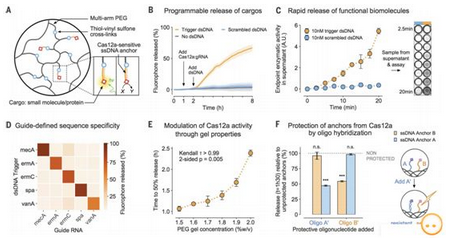
图片来自Science, 2019, doi:10.1126/science.aaw5122。
论文通讯作者、哈佛大学威斯生物启发工程研究所创始核心学院成员James Collins博士说,“我们的研究表明CRISPR的力量可以在实验室之外用于控制DNA反应性材料的行为。我们开发了一系列具有不同能力的材料,这就突显了可编程的CRISPR反应性智能材料(CRISPR-responsive smart material)所支持的应用范围。这些应用包括新型治疗诊断策略、即时诊断以及对流行病爆发和环境危害进行的区域监测。”
论文共同第一作者、麻省理工学院研究生Max English说,“我们将单链靶DNA序列整合到聚合物材料中,要么作为悬垂货物的锚点,要么作为维持材料基本完整性的结构元件,并且能够通过提供Cas12a和一种作为刺激物的特定gRNA来控制不同的材料行为。”
2.Biomaterials:开发出一种无载体的多重基因编辑系统,可用于抗癌免疫疗法
doi:10.1016/j.biomaterials.2019.119298
在一项新的研究中,韩国科学技术研究院(KIST)的Mihue Jang博士及其团队和韩国世宗大学的Seokmann Hong教授及其团队开发出一种新的基因编辑系统,而且这种系统可同时抑制淋巴瘤细胞表面上表达的干扰免疫系统的蛋白和激活细胞毒性T淋巴细胞,因而可以用于抗癌免疫治疗中。相关研究结果近期发表在Biomaterials期刊上,论文标题为“A carrier-free multiplexed gene editing system applicable for suspension cells”。
基因编辑技术通过移除特定基因或编辑基因以恢复其正常功能来消除疾病的根本原因和治疗疾病。特别地,CRISPR基因编辑技术如今经常用于免疫疗法中,通过校正免疫细胞中的基因来诱导它们选择性地攻击癌细胞。
Jang博士改进了CRISPR基因编辑系统,使得在没有外部载体的情况下能够让这种基因编辑系统穿过细胞膜(ACS Nano, 2018,12,8,7750-7760)。然而,存在多个调节免疫活性的基因,而且诱导安全、便捷的免疫治疗技术尚未充分开发。通过合作,Jang团队和Hong团队进一步改进这种CRISPR基因编辑系统,开发出一种适用于免疫治疗的技术,从而允许在没有外部载体的情形下将基因转移到淋巴瘤细胞中,同时实现校正多个基因的目的。
3.Nature子刊:利用免疫正交直向同源物有望提高CRISPR-Cas9基因组编辑效率
doi:10.1038/s41551-019-0431-2
鉴于CRISPR-Cas9的功效和高通量能力,它引发了基因组编辑领域的变革。一项利用CRISPR-Cas9介导的基因组编辑的临床试验于今年年初开始,并且还将有更多的临床试验。然而,人们仍然关注Cas9蛋白在人体中的潜在免疫原性,特别是腺相关病毒(AAV)载体介导的Cas9递送在体内的应用。最近,几个独立的研究团队报道了人体对Cas9蛋白的免疫力早已存在。幸运的是,科学家们在自然界中发现了来自不同细菌物种的几种Cas9变体(Cas9的直向同源物)。
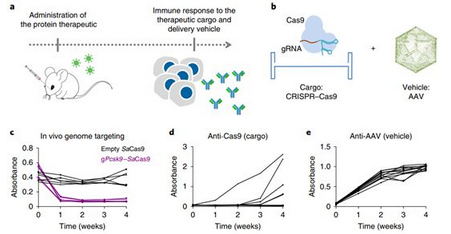
图片来自Nature Biomedical Engineering, 2019, doi:10.1038/s41551-019-0431-2。
考虑到这些因素,Moreno及其同事们在一项新的研究中,通过预测Cas9变体和AAV各自的氨基酸序列对主要组织相容性复合物I型(MHCI)和II型(MHCII)的结合能力来分析它们的免疫正交性(immune-orthogonality)。通过使用Cas9和AAV的免疫正交直向同源物(immune-orthogonal ortholog),它们在预先接受Cas9蛋白免疫的动物中实现了高效的基因组编辑。有趣的是,预先免疫仅导致编辑效率的部分降低,这表明抗Cas9适应性免疫应答在体内的影响是有限的。
然而,这项研究的一个重要限制是使用与人类相比具有有限MHC谱系的近交小鼠。这些研究人员承认,鉴于不同AAV衣壳之间的高度保守性和人群中众多MHC免疫基因的存在,使用免疫正交直向同源物可能是降低人类抗衣壳免疫原性的一个较差的解决方案。Cas9在体内的使用可能存在类似的限制。然而,细菌中Cas9的进化具有较长的历史,并且每个月从不同的细菌菌株中分离出新的Cas9变体。降低对Cas9产生适应性免疫应答的风险的另一种可能的解决方案是通过mRNA或蛋白递送实现Cas9核酸酶的瞬时表达。
4.Nat Commun:首次利用CRISPR从活动物基因组中清除HIV
doi:10.1038/s41467-019-10366-y
坦普尔大学刘易斯·卡茨医学院(LKSOM)和内布拉斯加大学医学中心(UNMC)的研究人员进行了一次重大合作,首次从活动物的基因组中消除了可复制的HIV-1 DNA,这是一种导致艾滋病的病毒。这项研究于近日在线发表在《Nature Communications》杂志上,它标志着人类艾滋病病毒(HIV)感染可能治愈的关键一步。
"我们的研究显示,先后进行抑制艾滋病毒复制的治疗和基因编辑疗法可以从感染动物的细胞和器官中消除艾滋病毒。" Kamel Khalili博士说道,他是LKSOM的Laura H. Carnell教授、神经科学系主任、神经病毒学中心主任、综合神经艾滋病中心主任。Khalili博士和传染病和UNMC内科教授、药理学和实验神经科学系主任、神经退行性疾病中心主任Howard Gendelman博士是这项新研究的通讯作者。
在之前的工作中,Khalili博士的团队使用CRISPR-Cas9技术开发了一种新的基因编辑和基因治疗传递系统,旨在从HIV病毒的基因组中去除DNA。在大鼠和小鼠中,他们发现基因编辑系统可以有效地从感染细胞中去除大量的HIV DNA片段,显着影响病毒基因的表达。然而,与ART类似,基因编辑本身不能完全消除艾滋病毒。
在这项新研究中,Khalili博士和同事们将他们的基因编辑系统与最近开发的一种名为长效缓释(激光)技术的治疗策略相结合。激光技术是由Gendelman博士和UNMC药理学助理教授Benson Edagwa博士共同开发的。激光抗逆转录病毒治疗以病毒避难所为目标,在较长时间内维持低水平的艾滋病毒复制,从而降低抗逆转录病毒治疗的频率。由于抗逆转录病毒药物的化学结构发生了药理学上的变化,这些长效药物得以问世。这种经过修饰的药物被包装成纳米晶体,纳米晶体很容易分布到HIV可能潜伏的组织中。从那里,储存在细胞内数周的纳米晶体慢慢释放药物。
研究人员用老鼠来制造易受HIV感染的人类T细胞,允许长期的病毒感染和ART诱导的潜伏期。一旦感染被确定,小鼠接受激光治疗,随后使用CRISPR-Cas9治疗。在疗程结束时,对小鼠进行病毒载量检测。分析显示,大约三分之一的感染艾滋病毒的小鼠体内的艾滋病毒DNA完全消失。
5.Nature:科学家用CRISPR成功治疗肌营养不良症
doi:10.1038/s41586-019-1430-x
来自加拿大、美国和瑞典的一组研究人员发现,在肌营养不良小鼠模型中,编辑一个参与产生促进肌肉力量的蛋白质的基因可以减轻症状。在他们发表在《Nature》杂志上的论文中,该小组描述了他们对老鼠的实验以及他们从中学到的新知识。
肌营养不良是一种遗传性疾病,在这种疾病中,肌肉质量会减弱,导致机体虚弱,最终导致残疾。此前的研究表明,这种疾病由一种名为Lama2的基因突变引起。这种基因突变会导致无法产生肌肉正常生长需要的蛋白质。它还会破坏神经髓鞘,导致神经损伤。到目前为止,靶向该基因的努力并没有给患者带来多大的改善。在这项新的研究中,研究人员采用了一种新的方法--编辑相关基因。
与之相关的基因被称为Lama1,它也参与了肌肉生产和发育过程中蛋白质的生成。但与Lama2不同的是,它可以通过基因调整编辑促进增加另一个叫做laminin-α1的蛋白质的生产,也可以促进肌肉组织的生成。这项新研究的研究人员在小鼠模型上尝试了这种方法。他们指出,要做到这一点,需要使用CRISPR来开发一个基因激活系统,该系统能够处理参与这一过程的大型病毒载体,而这个过程不会在螺旋结构中产生DNA双链断裂。
研究人员报告说,在老鼠身上测试基因编辑技术显示出积极的结果。小鼠的纤维化程度有所降低,肌纤维体积增大,这在某些情况下减少或阻止了症状的发生。他们还发现,治疗因疾病而瘫痪的老鼠可以让它们站起来走动。他们发现神经传导速度也加快了,这是髓鞘破坏逆转的迹象。
6.Nature子刊发布CRISPR-Cas重大进展:实现同时编辑几十个基因!
doi:10.1038/s41592-019-0508-6
每个人都在谈论CRISPR-Cas。这种生物技术提供了一种相对快速和简单的方法来操纵细胞中的单个基因,这意味着它们可以被精确地删除、替换或修改。此外,近年来,研究人员也一直在使用基于CRISPR-Cas的技术系统地增加或减少单个基因的活性。无论是在基础生物学研究领域,还是在植物育种等应用领域,相应的方法都在很短的时间内成为了世界范围内的标准。
迄今为止,在大多数情况下,研究人员只能用这种方法一次修改一个基因。有时,他们能一口气做到两三个;在一个特殊的情况下,他们能够同时编辑7个基因。现在,位于巴塞尔的苏黎世联邦理工学院生物系统科学与工程系的Randall Platt教授和他的团队已经开发出一种方法--正如他们在实验中证明的那样--可以同时修改细胞中25个目标基因位点。Platt认为这还不够,他表示这个数字还可以进一步增加,增加到几十甚至几百个基因。无论如何,这种方法为生物医学研究和生物技术提供了巨大的潜力。"多亏了这个新工具,我们和其他科学家现在可以实现我们过去只能梦想的事情。"
CRISPR-Cas方法需要一种称为Cas的酶和一个小RNA分子。它的碱基序列就像一个"地址标签",把酶精确地指向染色体上的指定作用位点。ETH的科学家们已经创造了一个质粒,,它存储了Cas酶的序列和许多RNA地址分子,并按顺序排列:换句话说,包含一个更长的地址列表。在他们的实验中,研究人员将这种质粒插入人类细胞,从而证明了几个基因可以同时被修改和调控。
对于这项新技术,科学家们并没有使用目前大多数CRISPR-Cas方法中所使用的Cas9酶,而是使用了相关的Cas12a酶。它不仅可以编辑基因,还可以把长长的"RNA地址列表"同时切成一个个"地址标签"。此外,Cas12a可以处理比Cas9更短的RNA地址分子。Platt说:"这些寻址序列越短,我们就能在质粒上找到越多的寻址序列。"
7.Science子刊:对特定的造血干细胞亚群进行CRISPR-Cas9基因编辑可有效逆转多种血液疾病的症状
doi:10.1126/scitranslmed.aaw3768
在一项新的研究中,来自美国弗雷德哈钦森癌症研究中心等研究机构的研究人员利用CRISPR-Cas9对长寿的造血干细胞进行编辑,从而逆转在包括镰状细胞病和β地中海贫血在内的几种血液疾病中观察到的临床症状。这是科学家们首次对成体造血干细胞中的一个特定亚群的遗传组成进行特异性编辑,其中造血干细胞是血液和免疫系统中所有细胞的来源。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“Therapeutically relevant engraftment of a CRISPR-Cas9–edited HSC-enriched population with HbF reactivation in nonhuman primates”。
在实验室培养皿中即将接受CRISPR/Cas9基因编辑的造血干细胞的显微图,图片来自Kiem lab / Fred Hutchinson Cancer Research Center。
这项原理验证研究表明对靶向干细胞进行高效修饰可能会降低血液疾病和其他疾病的基因编辑治疗成本,同时降低可能产生的副作用的风险。
论文通讯作者、弗雷德哈钦森癌症研究中心干细胞与基因治疗项目主任Hans-Peter Kiem说道,“通过展示如何针对一种疾病高效地编辑这个特定的细胞群体,我们希望对诸如HIV感染和一些癌症之类的疾病使用这种相同的方法。”
8.Nat Commun:囊性纤维化治疗新希望 科学家有望利用CRISPR-Cas技术剔除致病基因突变
doi:10.1038/s41467-019-11454-9
囊性纤维化是一种目前无法治愈的人类遗传性疾病,而科学家们也一直在与其抗争,特别是针对引发囊性纤维化的一些突变;近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自特兰托大学等机构的科学家们通过研究表示,他们或能利用基因编辑技术来推动CRISPR-Cas治疗引发囊性纤维化的遗传性问题。
相关研究结果有望为开发囊性纤维化新型疗法开启新的视角;囊性纤维化是由特殊的基因突变所引起,该基因能够产生囊性纤维化跨膜传导调节因子(Cftr),其功能异常会影响多个器官的功能,尤其是肺部,这项研究中,研究人员利用CRISPR-Cas基因编辑系统对引发囊性纤维化至少两种类型的突变进行了永久性地编辑,该技术名为SpliceFix,因为其能在修复基因的同时恢复蛋白质的产生机制。
博士研究生Giulia Maule表示,我们基于CRISPR-Cas设计出了一种基因编辑策略,其能永久性地移除诱发疾病的两种突变,CRISPR-Cas的工作原理类似于外科手术刀,其能以极高的准确率切断突变的基因元件,这种修复策略或能对患者机体衍生的类器官进行高精准对地修复,其能够仅靶向作用突变的序列,保留未突变DNA不受影响。
9.Nat Biotechnol:研究人员开发新的机器学习模型预测CRISPR-Cas9编辑人原代T细胞的结果
doi:10.1038/s41587-019-0203-2
在一项近日发表在《Nature Biotechnology》上、题为"Large dataset enables prediction of repair after CRISPR-Cas9 editing in primary T cells"研究中,来自Chan-Zuckerberg Biohub、斯坦福大学、加州大学等单位的研究人员在Alexander Marson、Andrew P. May和James Zou的带领下,通过对基因编辑后的原代T细胞进行大规模测序获得一个数据库,并以此为基础建立了一种机器学习模型来预测原代T细胞在CRISPR-Cas9基因编辑发后的基因修复。
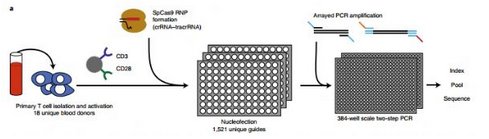
原发性T细胞是一种很有希望用于治疗性基因组编辑的细胞类型,因为它们可以在体外高效地进行工程设计,并可过继转移到患者身上。然而,目前还没有关于cas9依赖编辑的原代人类T细胞基因组编辑结果的详细信息。为此研究人员系统地描述了18例健康献血者原发性T细胞中的化脓性链球菌Cas9 (SpCas9)的修复结果。
研究人员对1656个人类原始T细胞靶基因位点的修复结果进行排序,并利用这些数据来训练一个机器学习模型,研究人员称之为CRISPR修复结果(CRISPR Repair Outcome,SPROUT)。他们发现SPROUT可以准确预测核苷酸插入和删除的长度、概率和序列,这将有助于对具有重要治疗意义的原代T细胞的基因编辑过程中的SpCas9引导RNA的设计。
10.Nat Biomed Engin:科学家利用CRISPR-Cas9成功实现T细胞重编程 有望开发出新型抗癌疗法
doi:10.1038/s41551-019-0409-0
从20世纪80年代开始,研究人员就提出了一种理念,即对患者自身的免疫细胞进行遗传修饰使其有效抵御机体感染和肿瘤,但截至目前为止,修饰后的T细胞仍然无法像天然T细胞一样有效发挥作用,这无疑限制了其在临床中使用的价值。近日,一项刊登在国际杂志Nature Biomedical Engineering上的研究报告中,来自慕尼黑工业大学的科学家们通过利用新型的CRISPR-Cas9基因编辑工具成功对T细胞进行工程化修饰,使其更像机体生理性质的免疫细胞。
研究者Dirk Busch教授表示,这项研究中,我们利用基因剪刀CRISPR-Cas9技术首次开发出了与机体天然副本非常相似的修饰T细胞,其或能帮助解决很多临床问题。常规的方法和新方法都能够靶向作用T细胞受体,该受体位于细胞表面,其能识别病原体或肿瘤细胞相关的特殊抗原,以便T细胞进行攻击;每一个受体都由两种互联的分子链组成,每一条链的遗传信息都能被遗传修饰产生新型手提,从而识别任何抗原,以这种方式,研究人员就能够实现对T细胞的重编程。
常规方法的问题在于,新受体的遗传信息会被随机插入到基因组中,这就意味着,T细胞会由新旧受体同时产生,或者受体仅有一条旧链或一条新链;因此,细胞就并不会像机体天然的生理性T细胞一样有效发挥作用了,而且其还会以不同的方式被控制,此外,链的混合还会诱发危险的副作用产生。研究者Kilian Schober解释道,利用CRISPR技术,如今我们就能够利用新的受体来完全替代天然受体,因为我们能够将其插入到基因组中的相同位点,此外我们还能够移除两条链的信息以便不再掺入任何混合的受体。