有效规避HPLC使用过程中的问题(一)
对高效液相色谱(HPLC)仪的生命周期进行风险评估的真正意义是什么?如何帮助用户解决操作色谱仪过程中遇到的问题,从而使其在性能认证(PQ)过程中被发现或在操作认证(OQ)过程中避免?本文会一一说明并助您探寻PQ与OQ在生命周期设计认证(DQ)阶段所起的作用。
GxP法规实验室必须对色谱仪进行认证,通常,应用4Q模型认证方法。4Q模型通常由四个相关联阶段构成:设计认证(DQ)、安装认证(IQ)、操作认证(OQ)及性能认证(PQ)。首先,可应用4Q模型对高效液相色谱仪(HPLC)生命周期风险评估进行讨论。第一步便是针对液相色谱在操作认证阶段(OQ)出现的问题进行风险评估。
风险管理与评估已逐渐成为制药领域专业术语,它们对监管机构和制药行业到底意味着什么?从监管机构角度出发,行业必须进行风险评估以控制某项活动及过程中最关键部分,并努力降低风险,将稀有资源放置于最需要之处并确定风险管理改进。
从可能使HPLC操作性出现问题功能说起(如图1所示),液相色谱仪由四个模块组成:泵、进样器(自动进样器)、柱温箱及检测器。由于,实验员的目的是考察液相色谱仪认证而非方法性能认证,图中省略了色谱柱,每个模块下方列出了可能发生的主要错误。
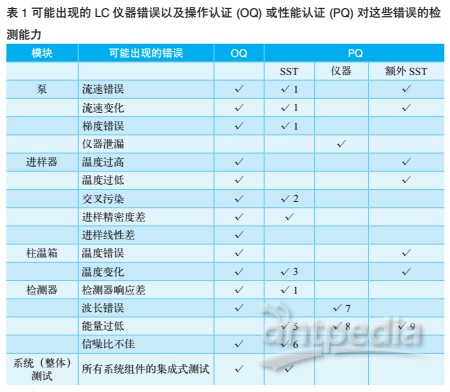
上表中显示数字对应的各种错误的讨论如下:
1. 流速变化将影响色谱峰保留时间的精确度,明显的流速或梯度错误可能使色谱峰超出预期保留窗口之外。
2. 交叉污染仅能在系统适用性测试中包含空白进样时被检测到(参见关于精益西格玛与科学合理 SST 的讨论)。
3. 柱温箱温度的变化将导致色谱结果或保留时间的改变。
4. 检测器响应值要如何变化才能被“检测到”?
5. 灯能量检测是否作为 SST 重点关注内容以外的 PQ 的一部分。
6. 需要利用空白进样或色谱图中的适当峰面积确定信噪比。
7. 这取决于仪器本身及其使用方式。如今,许多仪器在开机时均采用氘发射谱线进行波长诊断测试。
8. 如果灯能量低于某一特定水平,某些仪器可能会发出警告。
9. 需要进行检测器灯能量的手动检查。
如果实验室中仪器不具备某些特定功能,某些问题可能不会发生,例如,等度泵将不会产生梯度错误。在已列举出主要错误后,需要考虑的是这些错误可能在OQ或PQ中被检测到(如表1所示)。
PQ分为三个方面:系统适用性测试(SST)、检测问题仪器及额外SST组。
何为仪器性能认证?由于我们讨论的重点在于仪器生命周期操作阶段,同样需要考虑PQ。目前,USP中某项歧义涉及到OQ及PQ,尤其是它们应该包含哪些内容以及由谁对其负责。历史上,Questions of Quality于2008年被首次实施前所采用的是1987年美国食品药品管理局(FDA)过程认证指南,并将其应用于分析仪器认证。该指南得到实验室及服务供应商不同方式的诠释,如表1下方列出信息所示:执行活动本身远比活动执行所处阶段重要以及如果仪器进行了大修或改造,应该重复进行相关OQ及PQ测试。因此,在该种情况下,OQ及PQ可互换,但USP仍提供以下OQ及PQ定义:
操作认证是证明仪器在特定环境中能够依据其操作性能指标正常运行所必需的一系列书面活动。性能认证是证明仪器能够依据用户定义的性能指标持续稳定运行,并能适用于预期用途所必需的一系列书面活动。OQ和PQ的确具有完全不同的功能。OQ与标准化条件下的仪器测试相关。因此,可相对于DQ确认仪器在实验室中的正确操作,而PQ则针对重复进行OQ之间的仪器在实际使用条件下的适用性。
表一中显示数字对应的各种错误讨论如下:1.流速变化将影响色谱峰保留时间的精确度,明显的流速或梯度错误可能使色谱峰超出预期保留窗口之外。2.交叉污染仅能在系统适用性测试中包含空白进样时被检测到。3.柱温箱温度的变化将导致色谱结果及保留时间改变。4.检测器响应值要如何变化才能被“检测到”。5.灯能量检测是否作为SST重点关注内容以外的PQ的一部分。6.需要利用空白进样或色谱图中的适当峰面积确定信噪比。7.这取决于仪器本身及其使用方式。如今,许多仪器在开机时均采用氘发射谱线进行波 长诊断测试。8.如果灯能量低于某一特定水平,某些仪器可能会发出警告。9.需要进行检测器灯能量的手动检查。
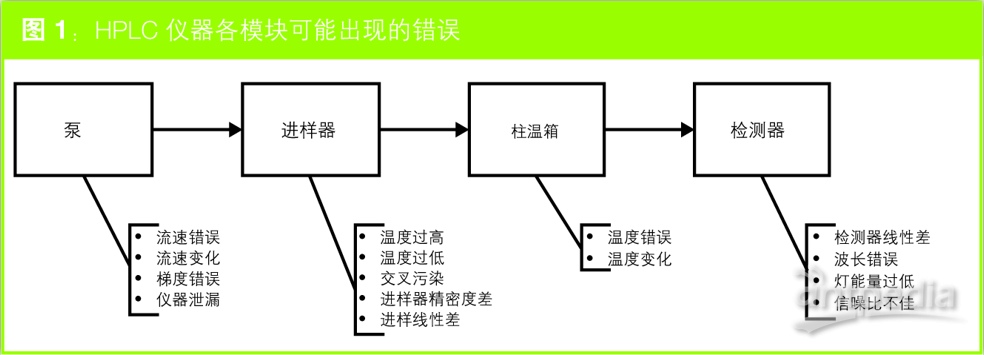
图1 HPLC仪器各模块可能出现的错误
仪器认证生命周期通常被描述或默认为一种线性模型,特别在USP中,该内容被列于一张表格中,然而要全面了解4Q模型,最好将前三个阶段以V模型表示,如图2所示。在该简化的V模型中,更容易看出4Q各阶段之间的关系。OQ证实了USP OQ的定义中概括出的性能指标,其中,假定执行OQ的任何人均了解DQ的内容,或DQ已被记录这一事实。
同时,对于管理DQ仍有持续的动态需求。这在一定程度上取决于DQ的定义方式(例如,如果将非常具体的药典要求或章节作为参考,那么药典每次更新时,该仪器的DQ都需要进行重新审核)。相反,在支持DQ的流程中满足任何高级法规认证要求,并且将DQ需求限定在仪器用途内是更有效的措施。
该图还强调:在仪器进行重要升级或采用以前没有涉及的新方法时,都需要对DQ进行审查 以确保仪器的适用性。如果没有此反馈回路,将会存在仪器无法适用于新应用的风险。另外,由于DQ和OQ之间存在联系,该图还着重表明OQ中是否需要包含不同的设定点以测试使用范围。根据所讨论的风险,OQ能够涵盖:新仪器的认证,在某确定时间段之后对现有仪器的重新认证,通常与预防性维护服务联系在一起;由于进行升级或开展超出现有范围的新应用而需要扩展已认证仪器的操作范围;已认证仪器的大幅移动,附带风险评估中对于OQ 测试的书面判定结果。OQ用于证明该仪器在固定时间点处依据DQ中的性能指标进行操作,从而证明其符合预期用途。此时,需要重申USP中陈述,即,常规分析测试中不包含OQ测试。
-
焦点事件
-
企业风采










