纳米材料在体外诊断技术中的应用(二)
2 纳米材料的不同信号模式在体外诊断中的应用
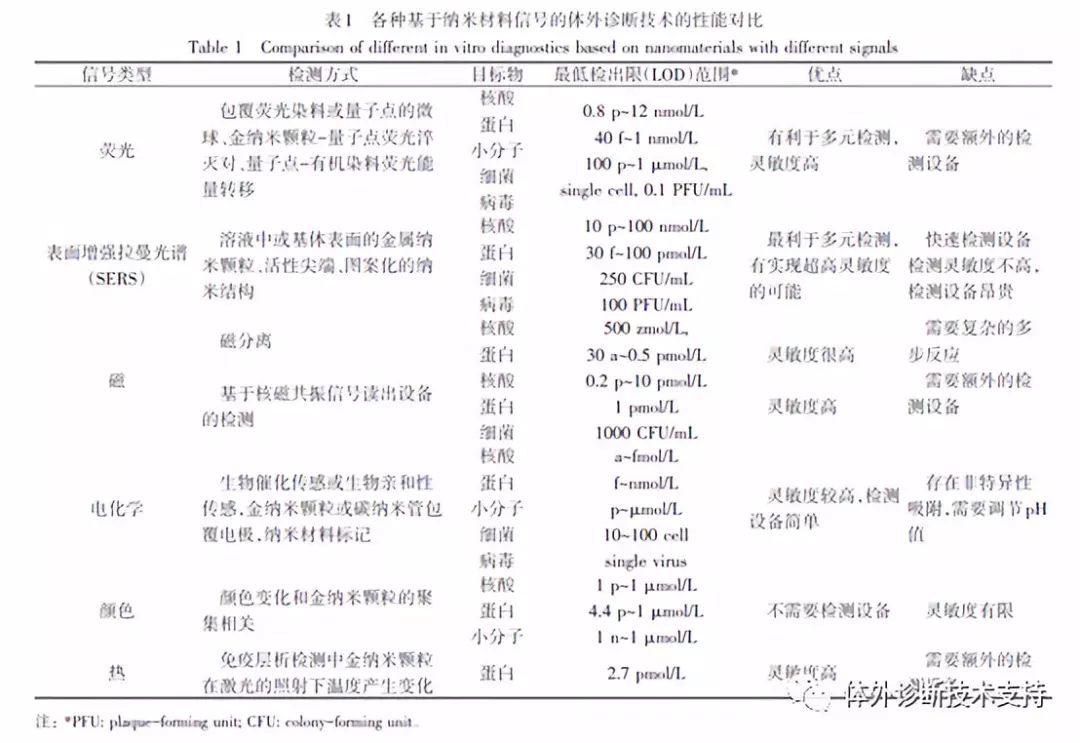
在过去的20多年里,大量的纳米材料被开发应用于体外诊断中,纳米材料独特的性能被用来提高传统体外诊断技术的检测性能以及开发全新的检测方法。其中利用纳米材料的荧光信号、表面增强拉曼信号、磁信号、电化学信号、颜色信号及热信号等作为体外诊断的信号检测模式最具代表性(表1)。
2.1 基于荧光信号的纳米体外检测应用
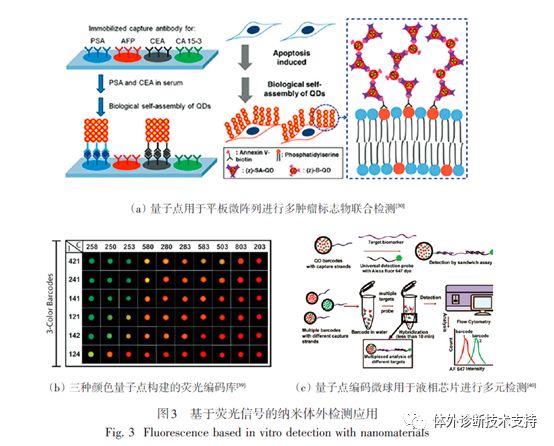
基于荧光的检测技术主要用于目标物为核酸或者蛋白的检测。但是,传统的荧光染料由于容易光漂白、量子效率不高及较宽的荧光光谱等导至其多指标检测能力有限。而窄的吸收光谱导至不同的荧光染料需要不同的激光器来激发,因此,半导体量子点常被用来解决传统荧光染料的这些缺陷。量子点在酶联免疫吸附实验(ELISA)免疫检测和DNA微阵列检测中可用做报告荧光分子实现化学残留物和癌症抗原标志物的单指标或者多指标的检测(图3(a)),这个系统检测肌红蛋白的检测限(LOD)可达subattomolar级别。量子点还可以应用于基于能量转移(FRET)的检测和多指标检测(图3(b、c))。FRET检测系统利用量子点作为能量给予体,可以将其能量转移给受体或者猝灭剂,以实现小分子及核酸的检测,其灵敏度可分别达到10~103 nmol/L及1~103 nmol/L。量子点的多指标检测能力主要来源于其荧光编码能力,将不同组合的量子点引入聚合物微球中可以产生不同的荧光编码。量子点编码的微球表面可修饰DNA捕获探针,通过和荧光染料标记的目标DNA杂交后可同时产生编码信号和检测信号。研究表明,基于量子点编码微球的检测体系已成功实现了多种疾病的生物标志物检测,灵敏度高达pM级别。此外,在量子点编码微球表面包覆一层金属纳米壳层可通过金属增强荧光效应进一步提高其检测灵敏度(2个数量级),同时还可以获得更好的微球稳定性。量子点编码微球检测体系的多指标检测能力对于体外检测技术发展非常有利,可以有效降低多指标检测过程的人力成本和时间成本。近年来,一些新型纳米发光材料也被用于实现体外多指标检测。
金纳米颗粒由于其表面等离子共振效应,可用来淬灭其表面附近荧光染料的荧光。这种淬灭效应可以在较长的距离(约为75 nm)起作用,且依赖于金纳米颗粒的形状和大小。因此,金纳米颗粒可用于基于FRET的体外检测,在检测过程中,激发态电子的能量以非辐射跃迁的形式从荧光染料分子转移到纳米颗粒。该检测方法同样显示出改善的检测灵敏度、更好的选择性以及可同时淬灭多种荧光染料。此外,在金纳米颗粒-量子点检测系统中,量子点同样可被高效地淬灭,可应用于定量检测流感病毒的抗原及细胞内的病毒滴度,灵敏度可分别高达100 pmol/L和0.1PFU/mL。与金纳米颗粒类似,氧化石墨烯同样可以淬灭其表面附近荧光染料及量子点的荧光信号。氧化石墨烯可以偶联染料标记的单链DNA探针,并在目标DNA不存在的条件下淬灭其荧光信号,但是在与目标DNA片段结合后,DNA将从石墨烯表面释放,从而恢复荧光信号。
2.2 基于拉曼信号的纳米体外检测应用
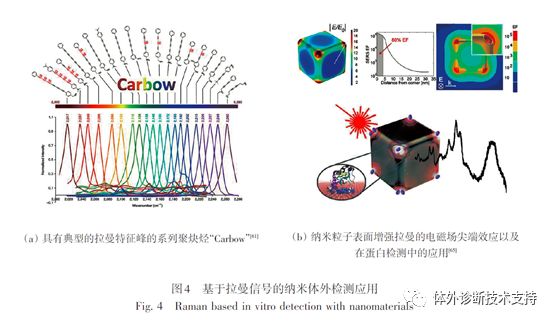
拉曼光谱学是一种通过分析材料的散射光谱获得材料分子的转动及振动方面信息,并应用于分子结构研究的分析方法。由于拉曼光谱包含具有多种元素特异性的光谱信号,其光谱的半高宽(FWHM)可窄至1nm,因此这种技术有望应用于多指标检测。最近研究人员通过调控炔烃的化学结构(苯环数目,C≡C数目,官能团邻间对位置以及不同的同位素),得到了一系列具有典型的拉曼特征峰的聚炔烃,且光谱很窄,并将其命名为Carbow。通过溶胀法可将10种不同拉曼特征峰的聚炔烃和3个强度水平进行微球编码,理论上可以得到310-1=59048个光谱编码的超级微球编码库(图4(a))。但是,传统的拉曼散射通常伴随着低的吸收截面,大大限制了检测灵敏度。金属纳米颗粒的表面等离子共振效应可用来增强拉曼信号(图4(b))。当拉曼分子接近金纳米颗粒表面或者处于2个或多个纳米颗粒之间的交叉SPR场产生的“热点”位置时,该信号将大大的增强(可高达1011倍),从而实现高灵敏的单分子检测。由于其吸收峰面积与浓度相关,因此可用来对目标分子进行定量分析。
产生强的“热点”,需要精确地控制纳米颗粒的形状,因此制备过程中费时费力。而且表面增强拉曼探针和热点之间的距离也需要非常严格地控制,距离相差几个纳米就有可能在增强信号上相差几个数量级。这将导至不同探针之间的增强性能差别较大,使定量分析复杂化。基于以上问题的考虑,大部分应用都是基于灵敏度更低的块体系统而不是单分子的纳米系统,其表面拉曼增强效果主要通过将探针固定在溶液体系的金属纳米颗粒表面获得。目前该技术已经成功用于核酸检测(10~100 pmol/L LOD)、蛋白检测(100 pmol/L LOD)、肿瘤细胞检测、细菌检测(250 cell/mLLOD)、病毒检测(100 PFU/mL LOD)及活细胞内小分子药物的示踪(100 pmol/L LOD)(图4)。该技术的主要缺点是探针必须在纳米颗粒的表面,限制了纳米颗粒的表面化学选择。此外,表面增强拉曼效应需要高能量激光器激发并且需要贵重的设备类获得信号,这阻碍了该技术应用于快速检测应用转化。
2.3 基于磁性能的纳米体外检测应用
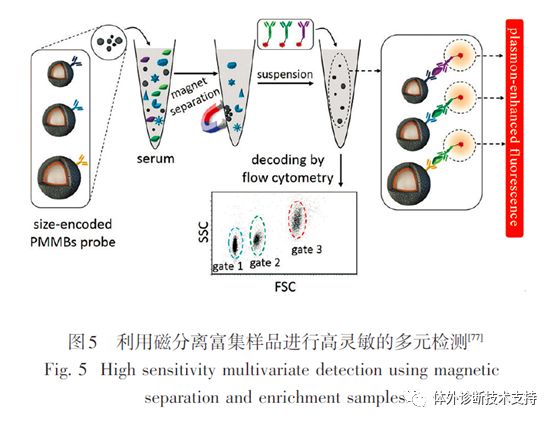
由于磁性纳米颗粒在磁场条件下可以分离不同的反应物,因此已经被广泛应用于生物检测试剂的开发上。在生物检测中使用磁性纳米颗粒可简化检测过程中涉及分离或者洗涤步骤的设计,常规的量子点编码微球检测体系可通过在编码过程中加入磁性纳米颗粒,结合磁场和微流控设备实现其自动化检测,将整个检测过程简化(图5)。磁分离同样被用在高灵敏度生物编码检测技术上,该检测将磁性纳米颗粒和金报告纳米颗粒相结合,2种颗粒的表面都修饰了核酸或者蛋白,用来识别和结合目标分析物。结合分析物可将2种颗粒桥接在一起,使得金纳米颗粒可随着磁性纳米颗粒通过磁场被分离出来。这样编码DNA可从金纳米颗粒上释放出来,最终通过检测仪检测出来。
磁性纳米颗粒同样可以直接用作报告探针,通过其产生的磁信号指示目标分子的存在。样品的横向弛豫时间(T2)的变化可通过微型核磁共振仪检测出来,该变化可通过目标DNA存在的情况下用磁性纳米颗粒修饰微球的表面,用磁性纳米颗粒标记目标细胞的表面、目标分析物存在的情况下磁性纳米颗粒之间的团聚等方式获得。研究结果表明该技术可成功实现蛋白(1 pmol/L LOD)、核酸(0.2~10 pmol/L LOD)、肿瘤细胞(2 cell)和细菌(1 CFU/uLLOD)的检测。
磁性纳米颗粒同样可以直接用作报告探针,通过其产生的磁信号指示目标分子的存在。样品的横向弛豫时间(T2)的变化可通过微型核磁共振仪检测出来,该变化可通过目标DNA存在的情况下用磁性纳米颗粒修饰微球的表面,用磁性纳米颗粒标记目标细胞的表面、目标分析物存在的情况下磁性纳米颗粒之间的团聚等方式获得。研究结果表明该技术可成功实现蛋白(1 pmol/L LOD)、核酸(0.2~10 pmol/L LOD)83])、肿瘤细胞(2 cell)和细菌(1 CFU/uLLOD)的检测。
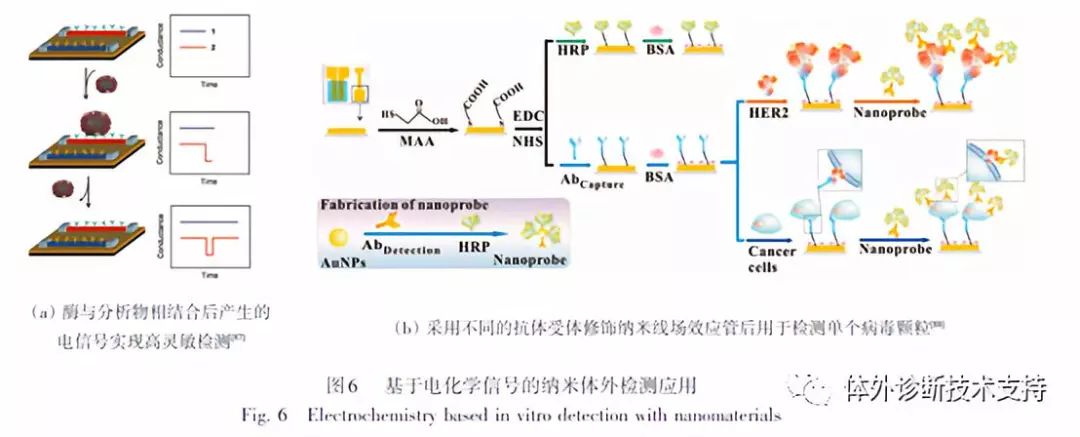
2.4 基于电化学信号的纳米体外检测应用
电化学生物检测是过去50年来逐渐发展起来的另一类生物传感技术。该技术的核心是传感器,它可以将与化学分析物相互作用后使系统电学性能(如电流、电位或者阻抗)发生变化的信号通过电子设备检测出来。这种技术主要有生物催化传感和生物亲和性传感2种检测途径。在生物催化传感途径中,酶被固定在电极的表面,其底物为目标分析物。当酶与分析物相结合后,将产生电活性的化学物质,或者直接将电子传递到电极。一般采用高催化活性的酶可获得高检测灵敏度(fmol/L)(图6(a)),而底物的特异性结合将使得复杂的混合物检测不需要样品的预处理。但是,这种方法的主要缺点是酶只能用于有限数量的底物。而在生物亲和性传感检测途径中,电极上一般预先包覆抗体或者DNA探针,用于识别目标蛋白、小分子抗原或者用来和互补的DNA杂化。当目标物和这些探针结合后将调节表面的电学性能,从而改变检测的电信号。由于抗体可用于大量抗原,而DNA探针则可被设计成各种序列,因此这种技术可以推广至多种目标检测物。但是,由于没有信号放大的步骤,该检测方法的检测灵敏度仍然受到一定的限制。
为了提高生物亲和性电化学传感的检测灵敏度,多种基于纳米材料的检测方法被开发出来。如采用不同的抗体受体修饰纳米线场效应管后用于检测单个病毒颗粒(图6(b))。电极上也可以包覆上金纳米颗粒或者碳纳米管,通过改变其阻抗从而获得更高的检测灵敏度。目前采用该技术已成功实现了DNA(pmol/L LOD)、蛋白质(1 nmol/L LOD[91])、病毒(单个)及细菌(10~100个)的高灵敏检测。而采用纳米颗粒-标记表面-结合分析物的类三明治结构可以通过提高阻抗强度的调节来获得更高的检测灵敏度,从而成功实现核酸(fmol/L LOD)和蛋白质(fmol/L LOD)的检测。DNA的多指标检测则可通过使用多种具有不同伏安特征的纳米晶标记实现。当然,电化学生物检测技术也同样存在一些缺点,包括非特异性吸附、需要控制检测溶液的离子强度以及相对短的使用寿命等。
2.5 基于颜色变化的纳米体外检测应用
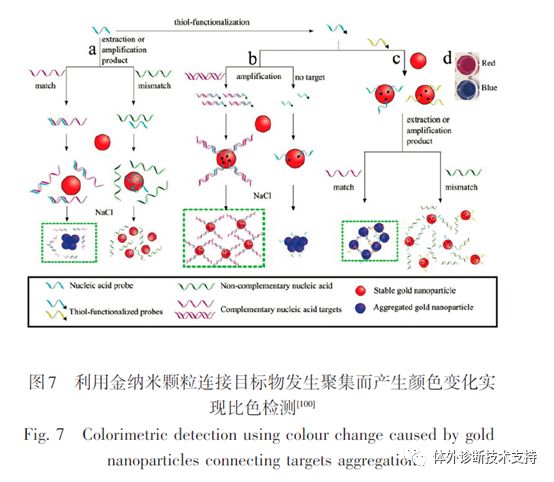
比色检测和其他检测方法相比的优势在于不需要任何的设备来读取信号,因此特别适合快速检测的应用。目前报道最多的是利用金纳米颗粒聚集后颜色发生变化来进行检测。由于SPR效应,金纳米颗粒在可见光范围显示出很强的吸收。常用于体外检测的金纳米颗粒粒径一般约为13 nm,其吸收峰约在520 nm,导至其溶液显示出亮红色。但是,当金纳米颗粒之间的距离小于它们的粒径时,它们的SPR场将发生耦合共振,使得溶液吸收峰向长波方向红移,导至溶液颜色发生从红到蓝的逐渐变化,且容易通过肉眼识别。目前已经有很多利用金纳米颗粒连接分析物导至其聚集,从而产生颜色变化,最终实现目标物的比色检测。
该比色检测技术可采用1种或者2种探针的策略实现目标物的检测(图7)。单探针策略中,金纳米颗粒表面用1种可和目标DNA互补的DNA探针修饰。当目标DNA存在时,由于金纳米颗粒表面的探针可以和目标DNA杂化,使得其可保持单分散性而不会聚集。而当目标DNA不存在时,由于溶液中盐的浓度较高将导至金纳米颗粒聚集,发生从红到蓝的颜色变化。双探针策略中,2种金纳米颗粒分别修饰不同的探针。当目标DNA存在时,2种金纳米颗粒通过目标DNA发生交联最终发生聚集。而目标DNA不存在时,2种金纳米颗粒都可以以单分散的形式稳定存在于溶液中。尽管基于金纳米颗粒聚集反应的比色检测简单、快捷且不需要任何贵重的检测设备,但是检测过程没有信号放大的步骤,导至其检测灵敏度有限(nmol/L级别)。金纳米颗粒与DNA 酶的偶联可以提供信号的线性放大,从而提高核酸检测的灵敏度。金纳米颗粒在从聚集态变化到单分散状态的过程中其吸收峰会发生蓝移,使溶液的颜色由暗紫色变为红色。因此,基于多组分核酸酶修饰金纳米颗粒的检测可提供简单、快捷的比色检测,适用于核酸的快速检测。但是对于检测一些浓度较低的目标物时仍然需要增加额外的信号放大步骤。
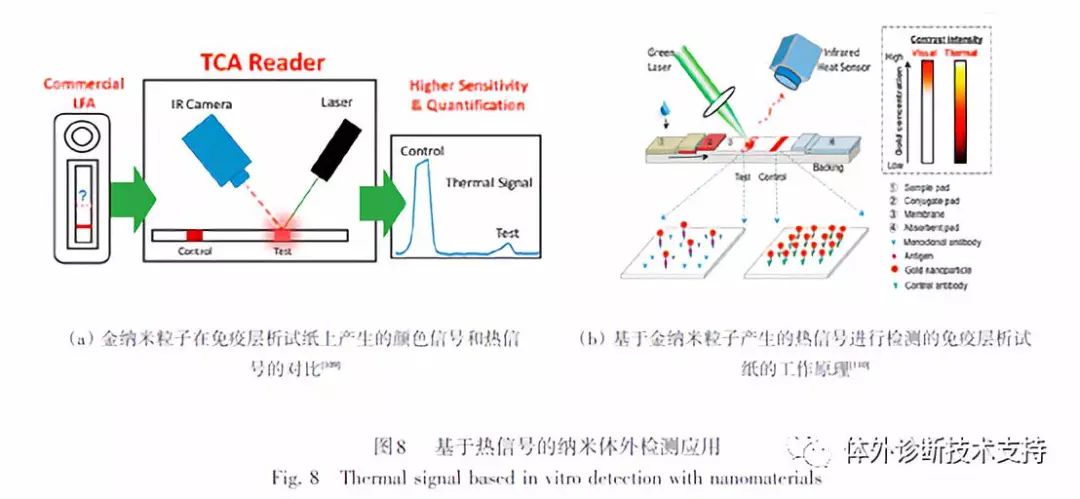
2.6 基于热信号的纳米体外检测应用
可以产生热的纳米颗粒一般常见于肿瘤组织的热疗应用中。最近已有研究开始利用金属纳米颗粒的热性能用于疾病的检测上。目前已经发现有很多类型的纳米材料可以在光或者电的激发下产生热,例如金纳米棒和碳纳米管等可在近红外激光的照射下产生热。被激发后,纳米材料中的电子和局部的水分子发生相互作用,当它们跃迁到基态时则发生振动和散热。最近,研究人员利用热成像技术探索了金纳米颗粒在侧向层析检测中的应用(图8)。在该系统中,抗体标记的金纳米颗粒作为对比剂产生的热信号可被热检测仪放大并检测出来。该检测仪可将激光波长和金纳米颗粒的等离子共振峰进行匹配,并用近红外探测器来检测温度的上升,最终实现金纳米颗粒信号的定量检测。目前,使用热对比信号检测可将侧向层析检测灵敏度提高32倍。通过使用热对比信号放大检测仪,在侧向层析条上检测甲型流感、疟疾和艰难梭菌与传统可视化层析检测相比,其灵敏度可提高8倍。尽管该技术还处于发展初期,研究结果表明该技术不仅可保持侧向免疫层析检测技术的简便性,还可提供更高的检测灵敏度,有望应用于更为复杂的分子检测。此外,目前众多光热性能优异的纳米材料同样为基于热信号体外检测技术的发展提供了更多选择。
3 结论
纳米材料近年来已被成功用于提高体外检测的灵敏度,提供不同的读出信号,并且可同时检测多个目标物并简化检测过程。基于纳米材料的体外检测可设计为颜色、热、荧光、磁、电化学及拉曼信号显示,有利于在检测系统中提供多种功能选择。显然,纳米体外诊断技术在诸多应用领域已呈现极大潜力,特别是在快速检测方面。但是,要实现纳米体外诊断技术在体外诊断领域的临床转化,仍然还有不少壁垒需要克服。
1)纳米材料在体外检测应用中涉及纳米材料的设计、合成、表面修饰和生物偶联等多个步骤,这些步骤对于确定纳米探针的整体性能非常重要。由于纳米材料表面化学的复杂性,因此发展更好的制备(特别是宏量制备)及修饰技术以获得性能重复性优异、表面涂层坚固以及功能化和生物偶联过程灵活的纳米探针至关重要。
2)目前的纳米体外诊断技术大多包括多个操作步骤,如样本的提取、纯化和检测,而这些过程均需要专业熟练的人员完成。因此,通过开发一体化的便携式设备实现自动检测,减少人力劳动,也是未来的发展方向。
3)目前很多纳米检测试剂盒还处于临床前的阶段,仍然需要从实际临床的角度通过大量临床样本来验证全面评价这些技术的性能。在纳米体外诊断技术的研发早期对其进行临床的评估有助于加速其临床转化,这样病人样本的多样性特点可以在技术设计过程就被考虑在内。
显然,从事纳米体外诊断技术的研究者应该聚焦于解决以上这些问题,这将有助于这些基于纳米材料的体外诊断技术最终实现临床转化,服务于社会,造福于普通百姓。
-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
焦点事件

-
企业风采

-
科技前沿