内瑞拉马脑炎病毒结合受体的分子机制
10月13日,《自然》(Nature)在线发表了中国科学院生物物理研究所研究员章新政课题组与清华大学医学院研究员向烨课题组合作完成的研究论文Structure of Venezuelan equine encephalitis virus with its receptor LDLRAD3。该研究解析了委内瑞拉马脑炎病毒(Venezuelan equine encephalitis virus,VEEV)病毒样颗粒及其与人源受体分子LDLRAD3复合物的高分辨冷冻电镜结构,揭示了甲病毒家族核衣壳蛋白和糖蛋白相互作用的病毒颗粒组装机制以及VEEV与受体特异性结合的分子机制。
VEEV是一种可以感染人类和所有马科动物的RNA包膜病毒,属于甲病毒家族,可通过蚊子传播及可经气溶胶高效传播,引发进行性中枢神经疾病和并发症,严重时导致死亡。此病毒在南美洲有感染病例报道,目前尚无疫苗和有效治疗药物。鉴于其能引发中枢神经疾病的危险性,VEEV被定为生物安全3级(BSL3)病毒。
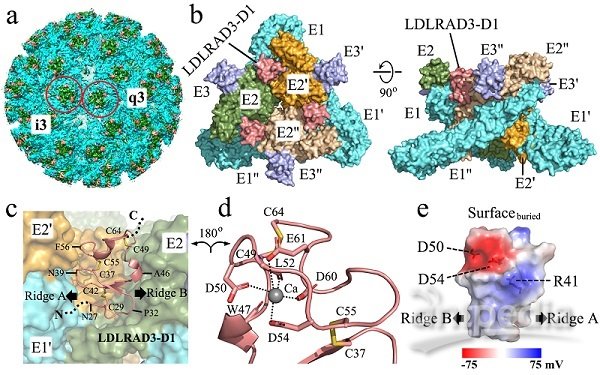
近期,LDLRAD3(含A类结构域的低密度脂蛋白受体3)被鉴定为VEEV的细胞受体,而VEEV病毒与受体结合的分子机制尚不清楚。章新政课题组和向烨课题组合作,运用课题组前期开发的分块重构算法,解析了VEEV病毒样颗粒(VLP)及其与受体复合物的高分辨冷冻电镜结构,这是首个同时解析外层糖蛋白和内层衣壳蛋白的高分辨率结构的甲病毒。病毒-受体复合物结构展示了LDLRAD3蛋白的胞外区结构域D1,通过疏水作用和极性作用插入到VEEV两个相邻病毒刺突糖蛋白E1/E2三聚体形成的裂缝之间,在病毒表面形成受体和E1/E2异源二聚体1:1的结合。结构分析鉴定了LDLRAD3-D1与VEEV结合的关键氨基酸残基,并利用定点突变实验验证了结构中观察到的关键相互作用位点。同时,研究发现,LDLRAD3-D1第41位氨基酸的突变使受体与病毒的结合能力提升约10倍,具有作为VEEV高效抑制剂的潜能,基于此,两个课题组联合申请了相关发明专利。此外,该结构首次揭示了甲病毒家族突刺糖蛋白和核衣壳蛋白相互作用的分子基础,并纠正了早期基于低分辨结构的一些错误认知。其他甲病毒如基孔肯雅病毒(CHIKV)与受体Mxra8的结合位置部分位于刺突蛋白间的裂缝中,但基孔肯雅病毒在其刺突E蛋白间的裂缝处缺乏与LDLRAD3-D1形成关键盐桥作用的氨基酸,显示两种甲病毒虽然结合受体分子部位部分重合,但是关键位点氨基酸的不同造成受体结合的选择性差异。
该工作得益于课题组早期开发的冷冻电镜重构技术——分块重构算法,是2018年运用分块重构算法解析第一个准原子分辨率甲病毒(辛德毕斯病毒SINV)结构之后的进一步延伸。研究工作得到国家重点研发计划、清华大学春风基金、国家自然科学基金、中科院战略性先导科技专项、中科院前沿科学重点研发计划的支持,并获得北京生物结构前沿研究中心、北京结构生物学高精尖创新中心、中科院青年创新促进会和北京市科技新星计划的支持。
VEEV VLP与受体复合物的高分辨率结构及相互作用