2021年7月Science期刊不得不看的亮点研究
2021年7月份即将结束了,7月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:减肥新机制!细胞因子TSLP通过促进皮脂分泌过多引起白色脂肪组织损失
肥胖及其相关并发症是全球关注的严重问题。尽管有越来越多的公共卫生措施,但肥胖率仍在上升。因此,亟需确定影响脂肪过多的途径。最近的研究已表明,免疫系统可以调节脂肪组织及其代谢功能。2型免疫细胞,如2型先天性淋巴细胞(ILC2)和嗜酸性粒细胞,会增加代谢率,而调节性T细胞(Treg细胞)会促进胰岛素敏感性。
胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin, TSLP)是一种上皮细胞的细胞因子,在皮肤、肺部和肠道等屏障部位表达。鉴于TSLP已被证明可激活2型免疫细胞和导致Treg细胞增殖,来自美国宾夕法尼亚大学佩雷尔曼医学院等研究机构的研究人员在一项新的研究中猜测TSLP可用来对抗肥胖及其相关并发症。相关研究结果发表在2021年7月30日的Science期刊上,论文标题为“Thymic stromal lymphopoietin induces adipose loss through sebum hypersecretion”。
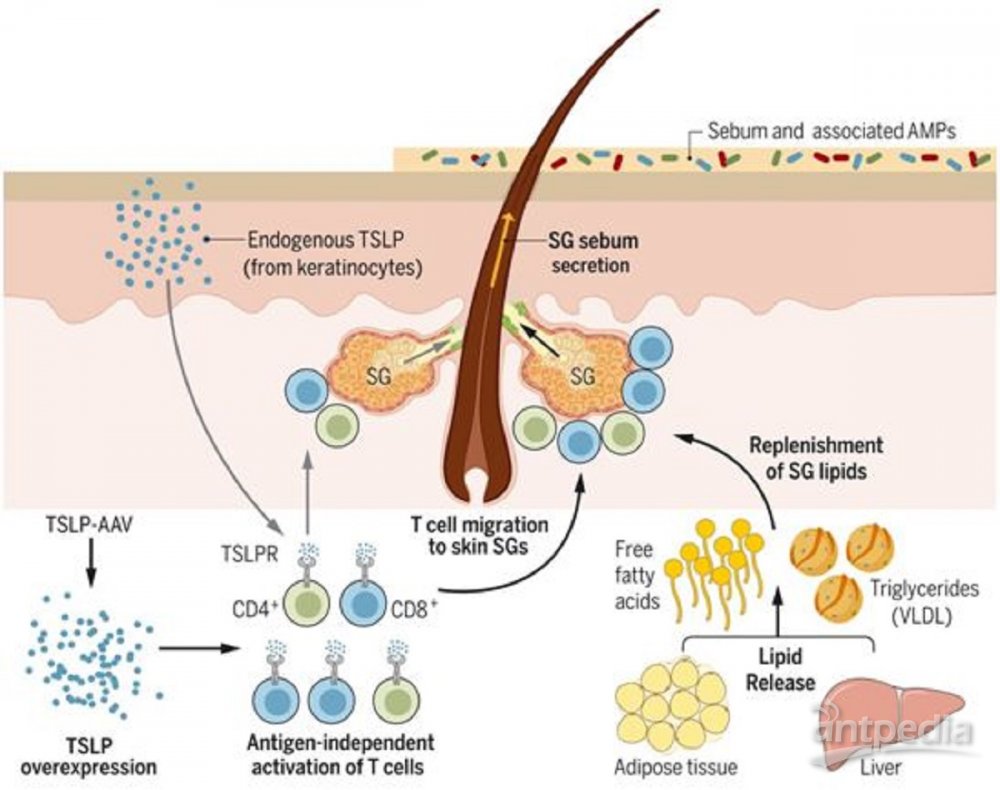
TSLP激活T细胞来促进皮脂分泌,图
这些作者通过给小鼠注射表达Tslp的腺相关病毒血清型8(TSLP-AAV8)来测试TSLP对肥胖的影响。与注射对照AAV8的小鼠相比,注射TSLP-AAV8的小鼠显示出选择性的白色脂肪组织(WAT)损失,这对饮食引起的和遗传性的肥胖、胰岛素抵抗和非酒精性脂肪性肝炎(NASH)模型有保护作用。出乎意料的是,TSLP诱导的白色脂肪组织损失不依赖于ILC2、嗜酸性粒细胞或Treg细胞。相反,它是由TSLP以不依赖于抗原的方式直接激活CD4+或CD8+αβ T细胞受体(TCRαβ)T细胞而产生的。来自注射了TSLP-AAV8的小鼠淋巴结的T细胞过继性转移也引起了TSLP受体缺陷(Tslpr-/-)小鼠的白色脂肪组织损失,这表明TSLP刺激的T细胞保留了它们诱导白色脂肪组织损失的能力。
TSLP诱导的白色脂肪组织损失与食物摄入量减少、粪便排泄热量增加或能量代谢增加无关。相反,白色脂肪组织损失与明显的油腻的毛发外观有关。对注射TSLP-AAV9的小鼠提取的毛发脂质的薄层色谱分析表明,这种油性物质富含皮脂特异性脂质。皮脂是一种由皮脂腺中的皮脂细胞产生的热量密集性物质,有助于形成物理性和免疫保护性皮肤屏障。皮肤组织学分析表明,TSLP促进皮脂分泌和皮脂细胞周转。皮脂分泌过多是TSLP诱导白色脂肪组织缺失的原因,因为TSLP没有诱导缺少皮脂的小鼠(asebia mice)中的白色脂肪组织缺失,而缺少皮脂的小鼠含有低形态的皮脂腺。TSLP还诱导T细胞向皮脂腺迁移,这是增强皮脂分泌所必需的。抑制T细胞迁移可防止TSLP诱导的皮脂分泌过多和随后的白色脂肪组织损失。
2.Science:对抗与年龄相关的VEGF信号不足可促进健康衰老和延长寿命
所有的体细胞都依赖血管来提供氧气和其他血液携带的物质,在某些情况下,还依赖血管内皮衍生的旁分泌因子。与其他器官系统一样,血管系统也会经历衰老,从而导致功能逐渐退化。鉴于血管对器官稳态的核心作用,有人假设血管衰老是机体衰老的上游的起始因素,但对这一主张的实验支持是有限的。血管衰老涉及大血管和小血管,后者的特点是毛细血管稀少,即与年龄有关的不能保持足够的微血管密度(microvascular density, MVD)。防止MVD减少的一个关键稳态机制依赖于血管内皮生长因子(VEGF)的血管生成活性,由于其缺氧诱导性,它不断地补充失去的血管并使血管供应与组织需求相匹配。VEGF在衰老过程中不能这样做到这一点的原因尚不清楚。
血管功能受损预计会扰乱器官稳态,从而促进年龄相关性的虚弱和疾病产生。因此,抵制血管衰老的关键方面可能是缓解这些症状的有效方法。假设衰老中的血管供应不足是由VEGF信号不足引起的,主要是(但不完全是)因为它在防止毛细血管损失方面起着不可或缺的作用,这促使以色列研究人员在一项新的研究中探究了确保VEGF信号维持在年轻时的水平是否能校正毛细血管损失及其后遗症。在血管功能恶化是多器官功能障碍的上游驱动因素的前提下,他们设想这种校正可能提供全面的老年保护。相关研究结果发表在2021年7月30日的Science期刊上,论文标题为“Counteracting age-related VEGF signaling insufficiency promotes healthy aging and extends life span”。
尽管在小鼠衰老过程中,VEGF的产生没有明显减少,但纵向监测显示,VEGF在多个关键器官中的信号传递大大减少。这与可溶性VEGFR1(sVEGFR1)产生的增加有关,这是通过VEGFR1 mRNA的选择性剪接及其捕获VEGF的活性的年龄相关变化产生的。通过使用转基因VEGF功能获得系统或腺相关病毒(AAV)辅助的VEGF转导,适度增加循环的VEGF,可以保持更年轻的VEGF信号水平,并提供保护以防止与年龄有关的毛细血管损失、损害灌注和下降的组织氧合。衰老的标志,如线粒体功能障碍、代谢灵活性受损、内皮细胞衰老和炎症反应,在经VEGF处理的小鼠中得到缓解。相反,通过有条件地诱导内皮细胞中的转基因sFlt1表达而使VEGF丧失功能,加速了这些与年龄有关的不良表型的产生。经VEGF处理的小鼠寿命更长,健康寿命更长,这体现在腹部脂肪堆积减少,肝脏脂肪变性减少,与更好地保存肌肉生成力相关的肌肉流失(肌少症)减少,骨质流失(骨质疏松症)减少,脊柱侧弯减少和自发性肿瘤的负荷减少。
3.Science:揭示脑膜B细胞起源自中枢神经系统边界的淋巴造血微环境
脑膜(meninge)是一种覆盖中枢神经系统(CNS)的三层膜:最外层的硬脑膜附着在颅骨骨膜上;两层内膜,即蛛网膜和软脑膜,覆盖着大脑皮质。脑膜室承载着先天性和适应性免疫细胞,为中枢神经系统边界区域提供持续的免疫监视。鉴于这种战略位置,脑膜免疫是神经免疫性疾病的一个关键组成部分。最近的研究已调查了脑膜髓样细胞的起源和动态。然而,对脑膜B细胞却知之甚少。
为了研究脑膜B细胞的表型,来自美国华盛顿大学等研究机构的研究人员在一项新的研究中使用了不同的高通量技术,如单细胞RNA测序(scRNA-seq)、飞行时间流式细胞仪(CyTOF)和单细胞B细胞受体测序(scBCR-seq)。他们通过流式细胞仪和共聚焦成像进一步证实了他们的发现。他们通过骨髓移植(BMT)和联体共生实验来确定脑膜B细胞的来源。最后,他们研究了脑膜B细胞在衰老过程中如何发生变化。相关研究结果发表在2021年7月23日的Science期刊上,论文标题为“Heterogeneity of meningeal B cells reveals a lymphopoietic niche at the CNS borders”。
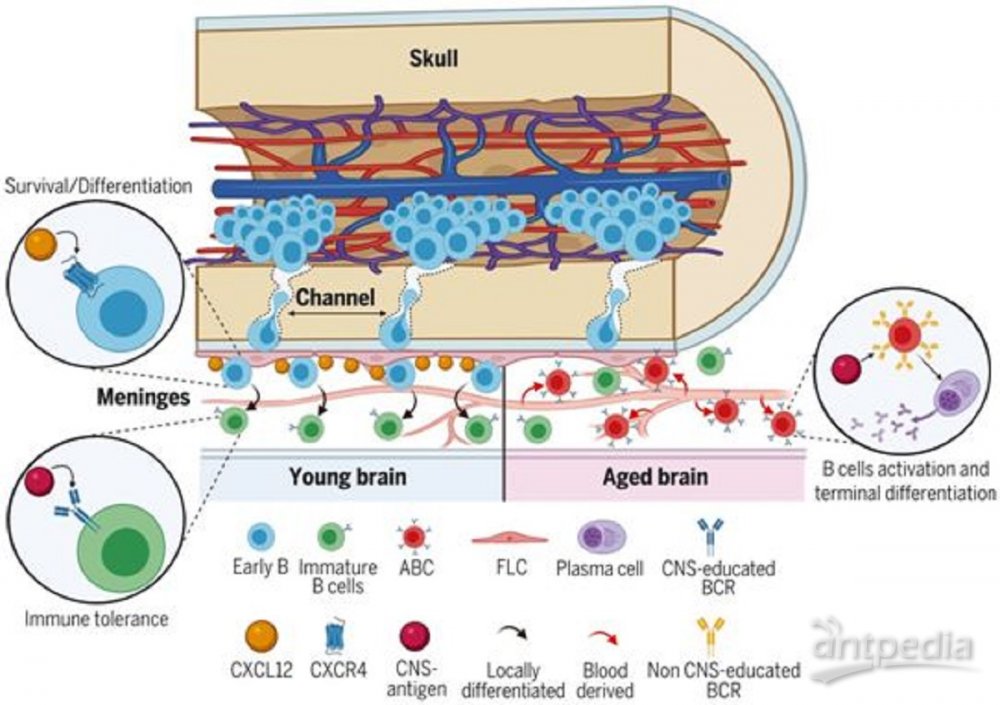
年轻小鼠和年老小鼠脑膜B细胞的组成。图
这些作者使用scRNA-seq对小鼠脑膜进行了表征,发现脑膜B细胞包含了多个发育阶段,从原B细胞(pro-B cell)到成熟B细胞。在骨髓中发现了相同的B细胞亚群,但在血液中没有发现这一点。CyTOF和流式细胞仪进一步证实了这一结果,表明正常存在于骨髓的早期B细胞亚群在稳态状态下也能在脑膜中找到。骨髓移植与颅骨骨髓的选择性重组显示,脑膜B细胞来自颅盖(calvaria),即位于颅骨扁平骨内的造血区域。然后,他们在野生型小鼠和在B细胞中特异性地表达tdTomato荧光蛋白的CD19-Tomato小鼠之间进行了联体共生实验。该实验表明,在稳态状态下,循环B细胞对小鼠脑膜的浸润很小。利用共聚焦成像,他们发现B细胞通过穿越内颅骨的专门血管通道从颅盖迁移到脑膜。他们对scRNA-seq数据的相互作用组(interactome)分析突出了脑膜B细胞和硬脑膜成纤维细胞样细胞(fibroblast-like cell, FLC)之间的分子通信网络。值得注意的是,他们显示硬脑膜FLC细胞表达高水平的Cxcl12,而硬脑膜早期B细胞表达它的受体Cxcr4。这些分子在各自细胞群体中的表达通过成像和流式细胞仪进行了验证。CXCL12-CXCR4轴对骨髓早期B细胞的生存和分化是必需的,同样的机制也可能存在于硬脑膜中。他们还发现,老年小鼠(约2岁)在硬脑膜中积累了年龄相关的B细胞(age-associated B cell, ABC)和浆细胞。与初始B细胞(naïve B cell)相比,ABC细胞具有重要的转录变化、V区库(V-region repertoire)的多样性减少和体细胞突变的积累,这表明它们存在抗原经验。通过scBCR-seq对B细胞克隆的分析表明,硬脑膜ABC细胞从外周渗入。在BCR克隆的基础上,他们还认为,硬脑膜ABC细胞可能在局部经历了终末分化,成为分泌免疫球蛋白(Ig)的浆细胞。
4.Science:大脑和脊髄硬膜中的非血源性髓样细胞起源于颅骨骨髓和椎骨骨髓
髓样细胞(myeloid cell)是高度异质性的,具有不同的个体发生(ontogeny)和免疫功能。包括单核细胞、巨噬细胞和中性粒细胞在内的髓样细胞群体在维持中枢神经系统(CNS)功能稳态中的不同作用越来越被认可。包括硬脑膜在内的大脑边界容纳着大量的对中枢神经系统进行免疫监视的髓样细胞。在损伤和神经炎症期间,髓样细胞渗入中枢神经系统,显示出与中枢神经系统驻留巨噬细胞---小胶质细胞---不同的功能。了解中枢神经系统边界(CNS border)和中枢神经系统实质(CNS parenchyma)在稳态状态和扰动状态下的髓样细胞个体发生过程,对于人们了解患病的中枢神经系统中的免疫反应的基本机制以及设计与炎症有关的神经系统疾病(如中枢神经系统损伤、慢性神经退行性疾病、中枢神经系统感染和脑瘤)的治疗方法至关重要。
髓样细胞是中枢神经系统功能的重要贡献者,但这些细胞在中枢神经系统边界的起源以及在炎症或神经退行性疾病条件下它们迁移到中枢神经系统实质的路线仍不清楚。在某些情况下---比如实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)中的单核细胞浸润或者在中枢神经系统损伤后,髓样细胞群体发挥着保护作用和病理作用。在一项新的研究中,来自德国美因茨大学、美国弗吉尼亚大学和华盛顿大学的研究人员认为这些不同的功能可能代表了不同的细胞来源,并试图调查髓样细胞浸润的来源以及它们进入受伤或发炎的中枢神经系统实质的途径。以前已描述过连接颅骨骨髓和硬脑膜的通道可允许中性粒细胞在中风期间迁移。因此,这些作者探讨了这些通道和颅骨骨髓微环境(bone marrow niche,也译为颅骨骨髓壁龛)是否也允许在稳态状态下和中枢神经系统疾病的小鼠模型中维持大脑中的硬脑膜髓样细胞库(dural myeloid pool)。他们进一步将他们的观察扩展到作为脊髄硬膜的潜在髓样细胞来源的椎骨骨髓微环境(vertebrae bone marrow niche)。相关研究结果发表在2021年7月23日的Science期刊上,论文标题为“Skull and vertebral bone marrow are myeloid cell reservoirs for the meninges and CNS parenchyma”。
利用共享血液循环的WT-UBC-GFP或CD45.1-CD45.2小鼠的联体配对,这些作者观察到大脑和脊髄硬膜中有大量的单核细胞和中性粒细胞,这些细胞不是来自血液,也不是来自组织固有的祖细胞或局部增殖。通过使用几种方法,包括颅骨-骨瓣移植和带有头部或身体屏蔽的选择性辐射方案以及骨髓转移,他们发现这些非血源性髓样细胞起源于颅骨骨髓和椎骨骨髓。他们再次证实了颅骨骨髓-硬膜通道的存在,并描述了连接脊髓椎骨骨髓和脊髓硬膜的类似通道的存在,这使得髓样细胞从局部骨髓库不断迁移的解剖路线成为可能。在各种中枢神经系统损伤模型(包括脊髓损伤、EAE和视神经挤压伤)中,他们发现中枢神经系统相关的骨髓有助于髓样细胞浸润中枢神经系统实质。利用单细胞RNA测序,他们证明了血液和中枢神经系统骨髓来源的单核细胞在脊髓损伤和EAE期间浸润脊髓的潜在非冗余作用,其中血液来源的单核细胞显示出更多的炎症表型和可能的致病表型。
5.Science:重大进展!揭示肠道HDL蛋白保护肝脏免受损伤机制
高密度脂蛋白(HDL)参与维持胆固醇稳态,也可能通过它与众多血浆蛋白的相互作用而具有抗炎或抗微生物的作用。肝脏合成体内的大多数HDL,但肠道也产生HDL。然而,肠道HDL与肝脏产生的HDL发挥的不同作用还没有被确定。HDL颗粒在重塑其货物时,会在组织空间中循环,但到目前为止,HDL在组织内的转运很少被研究。
在一项新的研究中,来自美国华盛顿大学圣路易斯医学院的研究人员推断,了解HDL的转运模式可能会深入了解它在健康和疾病中的作用,包括肠道制造的HDL是否与肝脏制造的HDL在功能上是冗余的。利用他们以前产生的可在任何组织位置上对HDL进行光标记的基因敲入小鼠,他们旨在追踪肠道合成的HDL的命运。相关研究结果发表在2021年7月23日的Science期刊上,论文标题为“Enterically derived high-density lipoprotein restrains liver injury through the portal vein”。
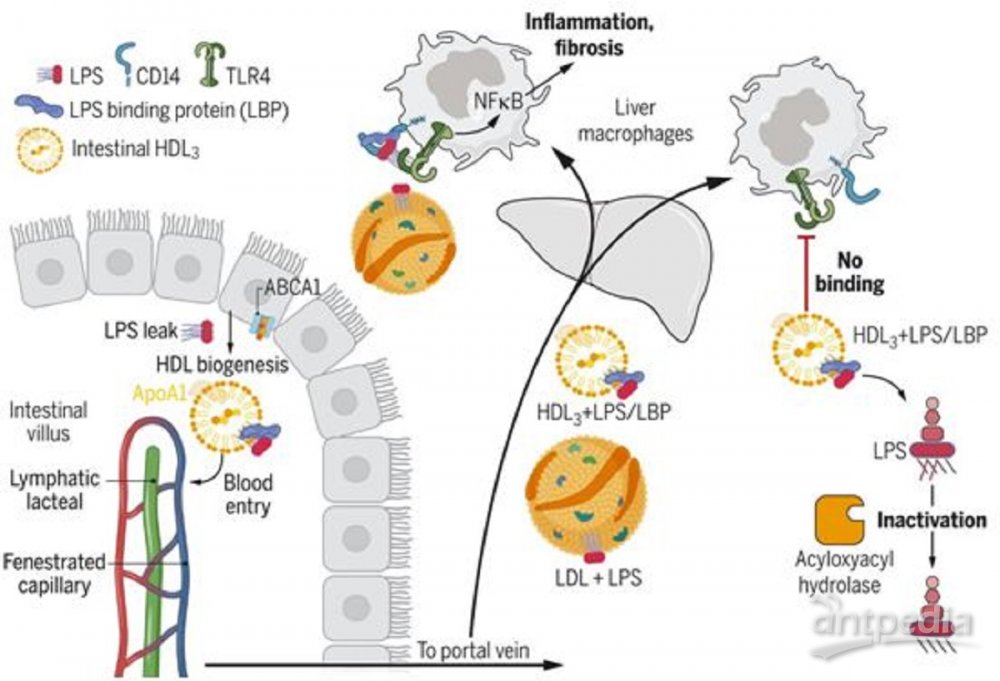
肠道HDL的转运和功能特性,图
来自小肠肠道细胞的光标记HDL在回肠产生得最多,并且没有像肠道细胞产生的乳糜微粒那样进入引流淋巴管。相反,肠道HDL迅速进入门静脉(portal vein),这是通往肝脏的主要血液供应。这一发现提出了肝脏是否可能从肠道HDL中受益的问题,并为他们指出了一个古老的概念,即HDL可能会中和一种可以从可渗透的肠道中逃逸出来的关键微生物信号:革兰氏阴性菌的脂多糖(LPS)。过去使用多种模型的研究已表明,LPS与它在肝脏中的受体---Toll样受体4(TLR4)---的接触会驱动重大的肝脏病变,包括进展为纤维化的炎症。利用生物化学、蛋白质组学和功能方法,这些作者观察到肠道产生一种特殊的HDL亚型,称为HDL3。与另一种HDL亚型(HDL2)不同,HDL3能有效地封存LPS,使其不能与TLR4+肝脏巨噬细胞结合。通过这种方式,肠道产生的HDL3保护肝脏免受多种小鼠肝损伤模型中观察到的炎症和纤维化,这些模型与人类的临床相关情况相似,包括小肠手术切除、饮酒或高脂肪饮食。给送一种靶向转录因子肝X受体(liver X receptor)---一种与HDL生物生成相关的基因的主调控因子---的口服药物,提高了肠道HDL水平,并保护小鼠免受肝脏病变。如果小鼠不表达来自肠道的HDL,这种保护就会消失,这表明肠道HDL是该药物的一种关键靶标。6份门静脉血样与相匹配的全身静脉血均证实了HDL3的富集。
从机制上讲,LPS结合蛋白(LBP)在HDL3颗粒中富集,并且是HDL3掩盖LPS而不被TLR4检测所需的。这一发现是出乎意料的,因为LBP通过将LPS传送到CD14,然后CD14再将LPS传送到TLR4,从而促进TLR4信号传递。因此,HDL3与TLR4信号平台的一个已知组分---LBP---相互作用,以掩盖LPS而不被检测到。如果不与TLR4结合,HDL3-LBP-LPS复合物就不能保留在肝脏中。相反,它离开了肝脏,而与它相结合的LPS被灭活。部分上由肝脏巨噬细胞产生的能使LPS中的关键脂肪酸残基脱酰基以便激活TLR4的酰基羧酸水解酶(acyloxyacyl hydrolase)仍能访问并作用于与HDL3结合的LPS,使之解毒。低密度脂蛋白(LDL)结合LPS,但不结合LBP,因此不能阻止LPS对肝脏巨噬细胞的激活。LBP与磷脂转移蛋白和胆固醇酯转移蛋白同属脂质结合蛋白家族,它们在重塑HDL的脂质结构方面有公认的作用。另一种微生物脂质,即来自革兰氏阳性细菌的脂磷壁酸(lipoteichoic acid),已知可与LBP结合。他们发现,它也与HDL3形成复合物,并抑制肝脏巨噬细胞的激活。
6.Science:重磅!利用多能性干细胞在体外成功重建支持卵母细胞发育的卵泡
doi:10.1126/science.abe0237; doi:10.1126/science.abj8347
在一项新的研究中,日本研究人员提供一种模型系统,用于利用小鼠多能性干细胞重建卵巢体细胞环境。相关研究结果发表在2021年7月16日的Science期刊上,论文标题为“Generation of ovarian follicles from mouse pluripotent stem cells”。
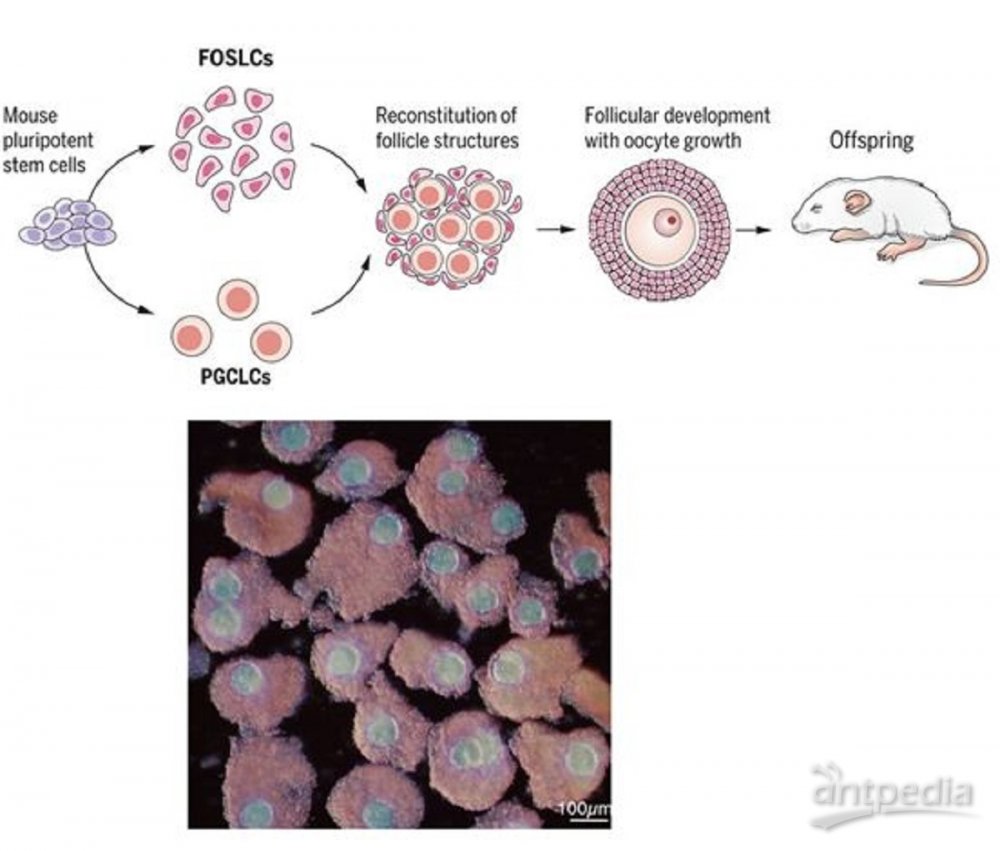
完全利用小鼠多能干细胞重建卵泡结构,包括卵母细胞。图
在小鼠发育过程中,胚胎卵巢起源于新生中胚层,其次是中间中胚层和生殖嵴区(genital ridge region)的体腔上皮(coelomic epithelium)。为了利用小鼠多能性 干细胞形成胚胎卵巢体细胞,需要在体外培养中提供适当的信号来模拟一系列在体内发生的胚胎事件。利用携带监测每个步骤的关键基因表达的报告基因的小鼠胚胎干细胞(mESC),这些作者着手探索重建这种分化过程所需的体外培养条件。诱导的胚胎卵巢体细胞应在适当的条件下赋予其可靠的基因表达和功能。这些诱导的胚胎卵巢体细胞的功能应通过支持产生能够受精和后续发育的功能性卵母细胞的能力来验证。
根据报告基因的表达,这些作者确定了一系列的培养条件是以逐步的方式重现从多能性干细胞到性腺体细胞的分化过程所必需的。在这些条件下,mESC通过新生中胚层、中胚层和体腔上皮细胞状态,分化为表达Nr5a1的胎儿卵巢体细胞样细胞(fetal ovarian somatic cell–like cell, FOSLC),其中Nr5a1是性腺体细胞的代表性标志基因。FOSLC表现出与胚胎第12.5天的胚胎卵巢体细胞类似的转录特征和细胞组成。当FOSLC与mESC衍生性的原始生殖细胞样细胞(primordial germ cell–like cell, PGCLC)聚集在一起时,PGCLC进入减数分裂,随后的卵母细胞生长伴随着FOSLC衍生的卵泡在体外培养中的发育。在FOSLC衍生的卵泡中发育的PGCLC衍生性卵母细胞能够受精并发育成活的后代。这些结果表明,这种重建的功能性卵泡结构完全能够支持卵母细胞的产生。
7.Science:在临床前动物中,抗衰老药物可降低冠状病毒相关的死亡率
COVID-19大流行揭示了老年人和慢性病人在感染SARS-CoV-2后对不良后果的脆弱性。衰老是一种由导致基因表达、形态、代谢和细胞凋亡抵抗性发生变化的细胞应激引起的细胞命运。衰老细胞(Senescent cell, SnC)分泌称为衰老相关分泌表型(senescence-associated secretory phenotype, SASP)的促炎因子。衰老细胞随着年龄的增长而积累,并推动慢性炎症的发生。在人类细胞和组织中,通过使用一种新的感染模式,来自美国明尼苏达大学等研究机构的研究人员探究了衰老细胞是否是随着年龄增长而导致感染不良结果的原因。这是有意义的,因为衰老细胞可以通过一类名为senolytics(衰老细胞裂解药物)的新药物在体内选择性消除,从而可能为治疗COVID-19提供一种新方法。相关研究结果发表在2021年7月16日的Science期刊上,论文标题为“Senolytics reduce coronavirus-related mortality in old mice”。
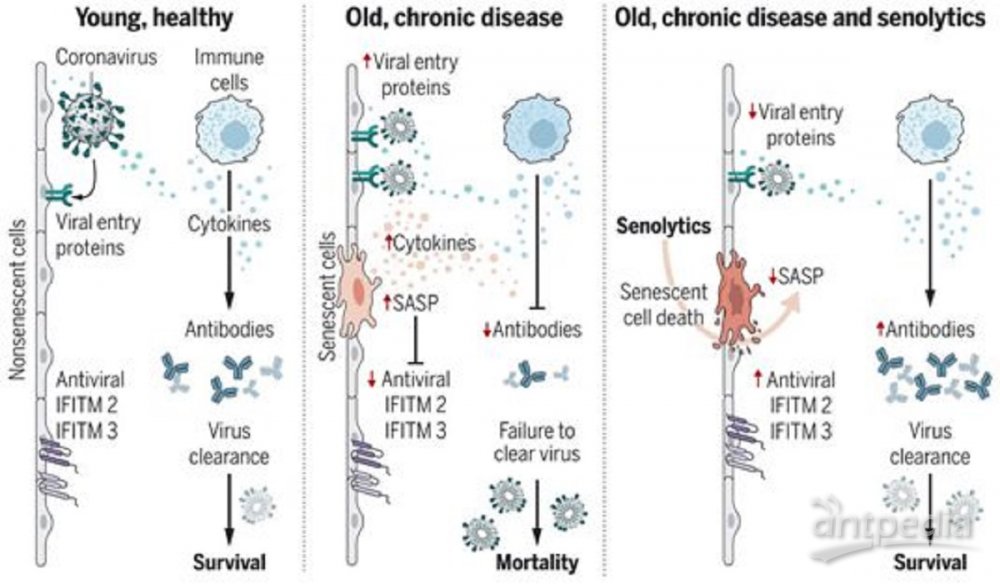
随着年龄增加或因慢性疾病积累的衰老细胞通过释放更多的SASP分子对PAMP分子(如SARS-CoV-2 S1)产生反应,这会增加正常细胞中病毒进入蛋白的表达,降低病毒防御基因IFITM表达。
这些作者假设,由于衰老细胞释放促炎性的SASP分子,它们可能对病原体相关分子模式(PAMP)因子有更高的反应,从而导致细胞因子风暴和多器官衰竭的风险增加。为了验证这一点,他们用PAMP因子---脂多糖(LPS)和SARS-CoV-2刺突蛋白(S1)---处理衰老和非衰老的人类细胞,并测量SASP及其对非衰老细胞的影响。同样地,在用LPS挑战老龄小鼠和早衰小鼠后,他们也测量了SASP。在此之前,他们通过让不含特定病原体(specified-pathogen–free, SPF)的小鼠接触宠物店的小鼠或它们的床上用品,将环境病原体传播给SPF小鼠,从而为它们创造了一种“正常的微生物体验(normal microbial experience, NME)”。第一种转移的病原体是小鼠肝炎病毒(MHV),它是一种与SARS-CoV-2密切相关的β冠状病毒。与年轻的SPF小鼠相比,NME迅速杀死了年老的SPF小鼠,而年轻的SPF小鼠在NME中存活。这提供了一种实验模式来测试senolytics药物是否能减轻β-冠状病毒感染的不良后果。
相对于非衰老细胞,人类内皮中的衰老细胞在受到LPS和S1的挑战时变得过度炎症。由PAMP引发的衰老细胞分泌组(secretome)导致病毒进入蛋白的表达增加,并减少了非衰老人类内皮细胞和肺上皮细胞中抗病毒基因的表达,这些事件在人类肺部活组织中被证实是相近的。相对于年轻小鼠,用LPS处理老龄小鼠明显增加SASP在几个器官中的表达,从而证实了这些作者在体内的假设。同样,暴露于NME的老龄小鼠显示出衰老细胞和SASP在多器官中的显著增加,对MHV的免疫反应受损,死亡率为100%,而在NME之前接种针对MHV的抗体可以完全拯救死亡。用选择性地消除NME处理后的衰老细胞的senolytics药物漆黄素治疗老龄小鼠,可使死亡率降低50%,减少血清和组织中炎性蛋白的表达,并改善免疫反应。这一点在第二种senolytics药物治疗方案---达沙替尼(Dasatinib)和槲皮素(Quercetin)的组合使用,以及老龄小鼠衰老细胞的基因消融中得到了证实,这确立了衰老细胞是导致老年生物体暴露于新型病毒病原体后的不良后果的原因。
8.Science:揭示辅助性T细胞表达Foxp3蛋白促进生发中心关闭机制
当我们接触到一种病原体时,免疫系统中的B细胞会涌向我们的淋巴结、脾脏和扁桃体。在那里,这些细胞在生发中心中发生突变,其中生发中心是让B细胞通过发生一连串的突变产生最有效的抗体来中和传染性病原体的微型训练营。只要生发中心启动并运行,B细胞就能自由地成熟并完善其抗病方法。但当生发中心关闭(通常是在几周后)时,这种训练过程就会停顿下来。无论到那时形成的抗体是好是坏,都是免疫系统的最终产物。
如今,在一项新的研究中,来自美国洛克菲勒大学等研究机构的研究人员描述了参与生发中心关闭的关键因素之一。这些发现最终可能会帮助科学家们延长或缩短生发中心活跃的时间,从而产生潜在的临床影响。相关研究结果发表在2021年7月16日的Science期刊上,论文标题为“Expression of Foxp3 by T follicular helper cells in end-stage germinal centers”。
论文通讯作者、洛克菲勒大学淋巴细胞动力学实验室负责人Gabriel D. Victora说,“如果我们能使生发中心持续更长的时间,也许我们可以在疫苗接种后帮助身体形成更强的抗体。反过来说,如果我们知道如何关闭生发中心,这可能有助于治疗由过度免疫反应引起的自身免疫疾病。”
这些研究结果首次强调辅助性T细胞是生发中心关闭的主要媒介,这提出了一种可能性,即专门干扰这些细胞可能使科学家们能够改变生发中心启动和运行的时间长度。例如,在我们接种疫苗后,延长我们生发中心的寿命,可能有助于诱导我们的免疫系统制造更强的抗体。另一方面,关闭生发中心可能有助于治疗自身免疫疾病---防止身体产生非常强大的靶向自身细胞并造成真正伤害的抗体。
9.Science:揭示人细胞利用具有洗涤剂特性的APOL3蛋白清除入侵细菌机制
当哺乳动物的免疫系统检测到病原体时,一种称为“干扰素-γ”的细胞因子的释放引发了一种免疫召唤,从而诱导全身细胞中大量宿主基因的转录,而不仅仅是在免疫细胞中。但是所有这些基因的身份以及它们在保护宿主方面的作用并不为人所知。在一项新的研究中,来自美国耶鲁大学的研究人员发现,由干扰素-γ刺激的一个称为APOL3(apopliprotein L3,载脂蛋白L3)的基因产生的蛋白可以通过像洗涤剂一样的作用来摧毁潜入宿主细胞的细菌---包围这种病原体细胞膜的脂质,使它们破裂开。相关研究结果发表在2021年7月16日的Science期刊上,论文标题为“A human apolipoprotein L with detergent-like activity kills intracellular pathogens”。
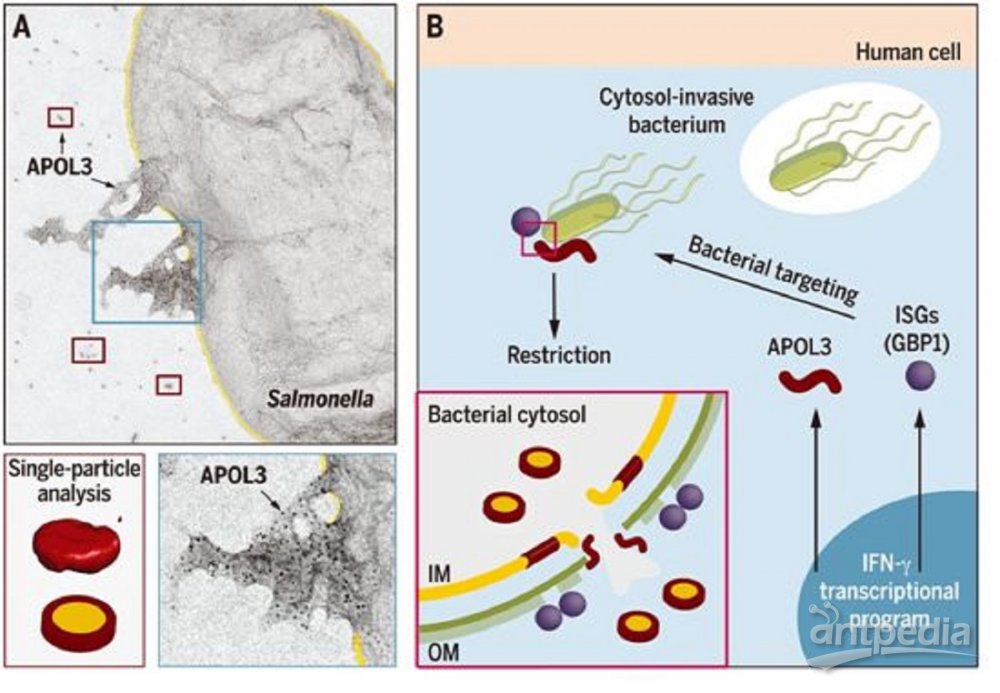
APOL3杀死人细胞内的细菌,图
耶鲁大学免疫学家John MacMicking和他的团队在人类上皮细胞中使用CRISPR,系统地让数千个能够在应对干扰素-γ时改变活性的基因中的每一个基因发生突变。他们然后将这些细胞暴露在干扰素-γ中,并发现APOL3发生突变的细胞不能抑制鼠伤寒沙门菌(Salmonella enterica serovar Typhimurium)的快速复制,其中鼠伤寒沙门菌是导致人们食物中毒的原因之一。他们确定,当细胞收到来自干扰素-γ的警告病原体入侵的信号时,它们会激活APOL3的表达。
为了弄清楚细胞如何利用APOL3来处理入侵者,这些作者观察了荧光标记的APOL3对荧光标记的细菌的反应,无论是在细胞内还是在培养皿中混合这些成分时。他们观察到APOL3与另一种由干扰素-γ诱导的蛋白质--鸟苷结合蛋白1(guanylate-binding protein 1, GBP1)---合作,穿过细菌外膜。然后,APOL3特异性地与细菌内膜的脂质结合,忽略宿主膜上常见的脂质,并将它们包围起来--就像洗碗皂包围锅碗瓢盆上的油脂那样。这种结合使膜破裂,从而破坏了细菌细胞。
10.Science:重大进展!揭示哺乳动物干细胞利用抗病毒Dicer抵御多种RNA病毒入侵
在一项新的研究中,来自英国弗朗西斯-克里克研究所的研究人员发现了一种以前认为随着哺乳动物的进化而消失的重要机制有助于保护哺乳动物的干细胞免受SARS-CoV-2和寨卡病毒等RNA病毒的侵害。他们认为,这一发现有朝一日可能在开发新的抗病毒治疗方法中得到利用。相关研究结果发表在2021年7月9日的Science期刊上,论文标题为“An isoform of Dicer protects mammalian stem cells against multiple RNA viruses”。
在这项新的研究中,这些作者分析了小鼠干细胞的遗传物质,并发现它包含了构建一种命名为抗病毒Dicer(antiviral Dicer, AviD)的蛋白质的指令,AviD可以切割病毒的RNA,从而阻止RNA病毒复制。这种保护形式被称为RNA干扰,植物和无脊椎动物的细胞也使用这种方法。
论文通讯作者、弗朗西斯-克里克研究所免疫生物学实验室的Caetano Reis e Sousa说,“了解干细胞如何保护自己免受RNA病毒的侵害是非常吸引人的。事实上,这种保护也是植物和无脊椎动物所使用的,这一事实表明,这种保护可能早在哺乳动物的历史上就存在了,直到进化树分裂的时候。出于某种原因,虽然所有哺乳动物细胞都拥有触发这一过程的先天能力,但似乎只有干细胞才会依赖它。通过进一步了解这一过程,并揭开我们免疫系统的秘密,我们希望为药物开发开辟新的可能性,因为我们努力利用我们身体抵抗感染的天然能力。”







