清华教授发文:首次揭示组蛋白巴豆酰化特异识别机制
生物通报道:组蛋白翻译后修饰是一类重要的表观遗传调控事件,被认为构成一类“组蛋白密码”,控制着染色质层面的遗传信息解读,在基因表达以及细胞命运决定等生命过程中发挥着关键作用。
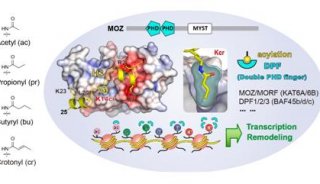
来自清华大学医学院李海涛研究团队近期在组蛋白翻译后修饰研究领域取得了重要突破:他们通过对表观调控因子AF9和YEATS2的结构与功能研究,首次发现YEATS结构域是一类偏好性组蛋白巴豆酰化修饰阅读器,并阐明了该结构域通过特异读取组蛋白巴豆酰化密码促进基因转录的分子细胞机制。
相关成果接连发表在Molecular Cell和Cell Research杂志上,这些研究由清华大学李海涛教授实验室,与洛克菲勒大学C. David Allis实验室、以及美国德克萨斯大学安德森癌症中心石晓冰实验室合作完成的。李海涛教授为两篇文章的共同通讯作者,李教授一直致力于表观遗传学的研究,发表了多项重要研究成果,详细见:李海涛课题组Genes Dev解析致癌组蛋白突变引发癌症的分子机制 、李海涛:把强大的工具做成有趣的科学
而最新这些研究成果是李海涛课题组继2014年在《细胞》发文首次证明YEATS结构域是一类新型组蛋白乙酰化修饰“阅读器”之后,在组蛋白修饰识别领域又一重要发现,填补了组蛋白巴豆酰化修饰识别机制研究的空白,开启了组蛋白巴豆酰化识别调控新篇章。
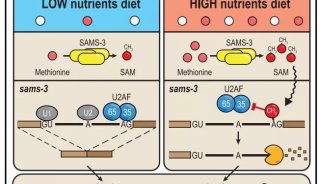
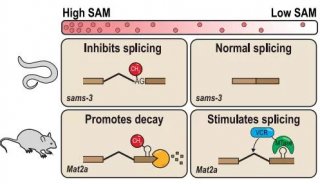
近年来,受惠于质谱、修饰特异抗体等技术发展,众多新型组蛋白修饰和修饰位点被不断发现。其中一大类是组蛋白赖氨酸酰基化修饰,如乙酰化(Kac)、丙酰化(Kpr)、丁酰化(Kbu)、巴豆酰化(Kcr)、二羟基异丁酰化(Khib)等。上述酰基化修饰的产生与细胞代谢密切相关,体现了表观遗传修饰和细胞营养代谢内环境的天然联系。
组蛋白赖氨酸巴豆酰化修饰是一类从酵母到人类都保守存在的“组蛋白密码”,它主要分布在活跃基因启动子区,或者潜在增强子区。与乙酰化修饰不同,在减数分裂后的精子细胞中,组蛋白巴豆酰化高度集中在性染色体上标记睾丸特异性基因,其中包括大量性染色体活性基因;这表明在男性生殖细胞分化编程过程中,组蛋白巴豆酰化是一种有别于乙酰化的重要转录激活相关修饰,在分化发育过程中可以帮助逃避基因沉默。自2011年组蛋白巴豆酰化修饰被鉴定出以来,围绕组蛋白巴豆酰化的产生、消除和识别机制研究成为了一个研究热点。最近的研究表明部分经典的乙酰基转移酶(如CBP/p300)同时具有巴豆酰转移酶活性,而部III型去乙酰化酶(如SIRT3)则具备去巴豆酰化酶活力。这些发现为研究组蛋白巴豆酰化的生理功能和调控机制提供了重要依据。尽管如此,组蛋白巴豆酰化修饰的特异识别“阅读器”目前却仍未发现。
发表在Molecular Cell杂志上的论文通过系统的定量结合和复合物结构解析等工作首次发现AF9 YEATS结构域是一类组蛋白巴豆酰化偏好型阅读器,其中AF9对组蛋白H3的9、18和27位赖氨酸巴豆酰化(H3K9cr,H3K18cr,和H3K27cr)的识别能力比相应的乙酰化提高了2-3倍;相比之下,同样是组蛋白乙酰化修饰阅读器家族成员的Bromo结构域却并不具备组蛋白巴豆酰化识别偏好性。
随后,李教授研究组与洛克菲勒大学的C David Allis教授实验室进一步合作,利用内毒素(LPS)刺激下的巨噬细胞基因表达体系,结合染色质免疫共沉淀、荧光定量PCR、深度测序等技术,证实AF9YEATS依赖的组蛋白巴豆酰化识别可以激发内毒素诱导的炎症应答基因表达。
而发表在Cell Research杂志上的论文,发现YEATS2蛋白的YEATS结构域是一个位点特异性的组蛋白H3K27cr阅读器;该结构域对巴豆酰化的识别比乙酰化强约7倍,而且还可以容忍分枝状的H3K27hib修饰(比乙酰化强约2倍)。
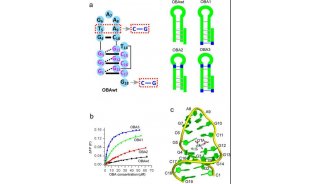
AF9和YEATS2的YEATS结构域复合物晶体结构解析(2.1-2.8Å)首次揭示YEATS结构域拥有一个保守的末端开放式“芳香三明治”(aromatic sandwich)口袋,通过一种“π-芳香环”(π-aromatic)相互作用实现对巴豆酰酰胺基团的偏好识别。这一识别特征与拥有侧面开放式口袋的Bromo结构域完全不同。
有趣的是,AF9和YEATS2的YEATS结构域所结合的多肽底物走向相反,证明不同YEATS结构域对组蛋白巴豆酰化的识别存在序列特异性。
-
项目成果
-
项目成果
-
会议会展
-
科技前沿
-
企业风采

-
综述
-
焦点事件

-
科技前沿
-
焦点事件

-
科技前沿
-
科技前沿

-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
焦点事件

-
科技前沿
-
项目成果

-
焦点事件
-
标准

-
项目成果
-
企业风采

-
焦点事件

-
项目成果

-
科技前沿
-
项目成果
-
项目成果
-
项目成果
-
项目成果

-
项目成果
-
项目成果
-
项目成果
-
项目成果
-
科技前沿
-
项目成果
-
项目成果