全球首款RNAi药物patisiran获批
Alnylam制药公司是RNAi疗法开发领域的领军企业。近日,该公司宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布积极意见,支持批准RNAi药物patisiran,用于遗传性ATTR(hATTR)淀粉样变性成人患者第1阶段或第2阶段多发性神经病的治疗。如果获批,patisiran将以品牌名Onpattro上市销售。
CHMP支持批准patisiran,是基于III期临床研究APOLLO的数据。该研究是一项随机、双盲、安慰剂对照、全球性研究,在伴发多发性神经病的hATTR淀粉样变性患者中开展,旨在评估patisiran的有效性和安全性。该研究共入组了225例伴发多发性神经病的hATTR淀粉样变性患者,涵盖了39个基因型。研究中,患者以2:1的比例随机分配至patisiran(0.3mg/kg,每3周静脉输注一次)和安慰剂治疗。研究的主要终点是治疗第18个月改良的神经病变损害评分(mNIS+7)相对基线的变化。mNIS+7是一种神经功能缺损的综合衡量工具,评估感觉运动能力、神经传导、反射和自主功能。次要终点包括Norfolk QOL-DN生活质量评分以及运动强度(NIS-W)、残疾(R-ODS)、步速(10米步行测试)、营养状况(mBMI)和自主神经症状(COMPASS-31)。探索性终点包括:存在基线心肌受累的患者中的心脏测量,以及皮肤活组织检查中皮肤淀粉样负担和神经纤维密度的测量。对于mNIS+7和Norfolk QOL-DN测量,较低分数意味着更好的临床结果。
研究结果显示,patisiran取得了极佳的治疗效果,达到了研究的主要终点和所有次要终点:与安慰剂相比,patisiran改善了多神经病、生活质量、日常生活活动能力、步行能力、营养状况、自主神经症状。此外,在心肌受累的患者(占研究患者总数的56%)中开展的一项心脏亚组分析结果显示,与安慰剂相比,patisiran在心脏结构和功能探索性终点方面也表现出显著改善。安全性方面,patisiran治疗组和安慰剂组不良事件发生率和严重程度均相似,patisiran治疗组周围水肿和输液相关反应发生率较高,但通常是轻至中度。
具体数据为:在治疗的第18个月,与安慰剂组相比,patisiran治疗组mNIS+7相对基线显著下降(p<0.00001)、生活质量明显改善(p<0.00001)。与安慰剂组相比,patisiran治疗组mNIS+7损伤评分和生命质量评分的平均值和中位数变化均为负值,说明在大部分患者和总体患者中相对基线都得到了改善。此外,在所有5个次要终点方面,与安慰剂组相比,patisiran治疗组均表现出统计学意义的显著有利差异(p<0.001)。心脏亚组分析结果显示,与安慰剂相比,patisiran与心肌病的显著改善有关。该研究中,patisiran的总体安全性令人鼓舞。patisiran组和安慰剂组不良事件发生率相似(AEs:96.6% vs 97.4%)、严重不良事件发生率也相似(SAEs:36.5% vs 40.3%)。
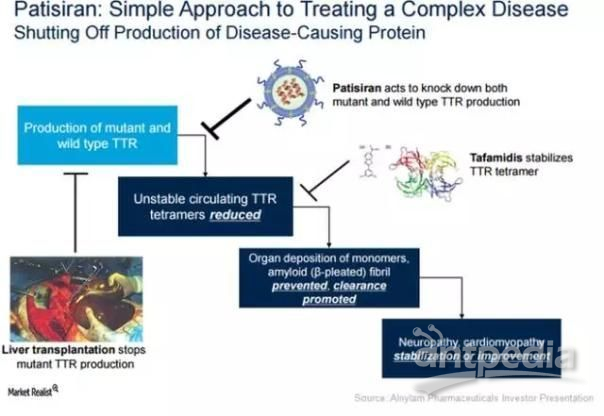
patisiran作用机制
patisiran是一种通过静脉注射的RNAi药物,靶向甲状腺素运载蛋白(TTR)。patisiran旨在靶向并沉默特异的信使RNA(mRNA),阻断TTR蛋白的生成,这可能有助于减少沉积并促进TTR淀粉样蛋白在外周组织中的清除,并恢复这些组织的功能。
目前,赛诺菲正与Alnylam合作开发patisiran,用于hATTR淀粉样变性的治疗。此前,patisiran已被美国FDA授予了突破性药物资格,目前正在接受FDA的优先审查和欧盟EMA的加速审查。FDA预计将在2018年8月11日做出最终审查决定。如果获批,该药将是RNAi现象被发现整整20年以来上市的首款RNAi药物。
业界对patisiran的商业前景也十分看好。今年6月,EvaluatePharma发布报告《World Preview 2018,Outlook to 2024》,盘点了全球20个最有价值的研发项目,patisiran以44.73亿美元的净现值(NPV)位列第18位。EvaluatePharma还预测,patisiran在2024年的销售额将达到13.08亿美元。
值得一提的是,本月中旬,来自美国生物制药公司Ionis的一款反义RNA药物Tegsedi(inotersen)获得FDA批准,用于hATTR淀粉样变性成人患者治疗第1阶段或第2阶段多发性神经病变。此次批准,使Tegsedi成为全球首个获批治疗hATTR的药物。