一文速览丨2019年曹雪涛团队在Science,PNAS发表成果盘点
2019年,曹雪涛团队在Science,Nature Immunology,PNAS 等杂志上发表了13篇重要研究成果,在免疫学领域取得重大进展,iNature系统盘点一下曹雪涛团队的研究成果:
【1】干扰素-γ(IFN-γ)对于细胞内细菌固有的免疫反应至关重要。 非编码RNA和RNA结合蛋白(RBP)在研究巨噬细胞中IFN-γ激活的信号通路的调控中不是很清楚。2019年11月18日,曹雪涛团队在Nature Immunology 在线发布题为“Inducible degradation of lncRNA Sros1 promotes IFN-γ-mediated activation of innate immune responses by stabilizing Stat1 mRNA”的研究论文,该研究发现microRNA miR-1通过降解胞质长非编码RNA Sros1,间接稳定Stat1信使RNA来促进巨噬细胞中IFN-γ介导的李斯特菌的清除。 Sros1的可诱导降解或遗传缺失导致先天免疫应答增强的IFN-γ依赖性激活。 这些发现揭示了复杂的RNA-RNA调控网络,参与了宿主-病原体相互作用中细胞因子引发的先天反应。
【2】宿主细胞代谢可以通过病毒感染来调节,从而影响病毒存活或清除。由病毒 -宿主相互作用中的N6-甲基腺苷(m6A)修饰介导的细胞代谢重新布线仍然是未知的。2019年8月22日,曹雪涛团队在Science在线发表题为”N6-methyladenosine RNA modification–mediated cellular metabolism rewiring inhibits viral replication“的研究论文,该研究发现,为了响应病毒感染,宿主细胞损害RNA m6A去甲基酶ALKBH5的酶活性。 这增加了α-酮戊二酸脱氢酶(OGDH)mRNA的m6A甲基化,从而降低了其mRNA稳定性和蛋白质表达。 总而言之,该研究显示OGDH和衣康酸以先天免疫非依赖性方式促进病毒复制,提出靶向OGDH-衣康酸代谢反应以控制病毒感染性疾病。
【3】DNA病毒通常在进入后将基因组DNA排出到宿主细胞的细胞核中。然而,尚不清楚核病原体衍生的DNA如何触发先天免疫反应。 2019年7月18日,曹雪涛团队在Science 在线发表题为“Nuclear hnRNPA2B1 initiates and amplifies the innate immune response to DNA viruses”的研究论文,该研究报道异质核核糖核蛋白A2B1(hnRNPA2B1)识别致病性DNA并扩增IFN-α/β的产生。因此,hnRNPA2B1在启动IFN-α/β产生和增强STING依赖性细胞质抗病毒信号传导中起重要作用。
【4】2019年6月25日,曹雪涛团队在PNAS 在线发表题为“An endosomal LAPF is required for macrophage endocytosis and elimination of bacteria”的研究论文,该研究发现LAPF(含有PH和FYVE结构域的溶酶体相关和凋亡诱导蛋白)是细胞膜内陷介导的内吞作用所必需的。Lapf缺陷型巨噬细胞具有内吞和消除细菌的能力受损。巨噬细胞特异性Lapf缺陷小鼠对大肠杆菌(E.coli)感染更敏感,细菌负荷更高。此外,Lapf缺乏损害TLR4内吞作用,导致TLR-触发的促炎细胞因子的产生减弱。LAPF定位于早期内涵体并与caveolin-1相互作用。酪氨酸激酶Src对LAPF的磷酸化是LAPF-Src -Caveolin复合物形成和内吞作用以及细菌消除所必需的。总的来说,该研究表明LAPF对细菌的内吞作用和诱导炎症反应至关重要,这表明LAPF和Src可能是控制传染病的潜在靶标;
【5】2019年6月18日,曹雪涛团队在Cell Research 在线发表题为“Interferon-inducible cytoplasmic lncLrrc55-AS promotes antiviral innate responses by strengthening IRF3 phosphorylation”的研究论文,该研究鉴定了一种新的细胞质长非编码RNA(lncRNA),lncLrrc55-AS,它驱动正反馈环以促进干扰素调节因子3(IRF3)信号传导和IFN-I产生;
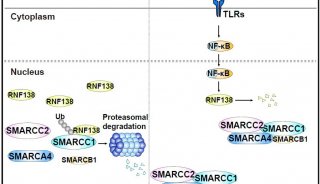
【6】2019年5月10日,中国医学科学院基础医学研究所北京协和医学院基础学院曹雪涛,姜明红等人在Cellular & Molecular Immunology 在线发表题为“E3 ubiquitin ligase RNF170 inhibits innate immune responses by targeting and degrading TLR3 in murine cells”的研究论文,该研究通过免疫沉淀巨噬细胞中的TLR3结合蛋白,将环指蛋白170(RNF170)鉴定为结合TLR3的E3连接酶。RNF170介导K766在TLR3的TIR结构域中的K48连接的多泛素化,并通过蛋白酶体途径促进TLR3的降解。RNF170的遗传缺失在体外和体内选择性地增强TLR3触发的先天免疫应答。 研究结果揭示了RNF170通过促进TLR3降解选择性抑制TLR3触发的先天免疫反应的新作用;
【7】2019年4月29日,浙江大学医学院曹雪涛团队在Nature Immunology期刊上在线发表题为“The long noncoding RNA Lnczc3h7a promotes a TRIM25-mediated RIG-I antiviral innate immune response”的研究论文,该研究确定了一种新的长非编码RNA(Lnczc3h7a),它与TRIM25结合并促进RIG-I介导的抗病毒先天免疫反应。 在机制上,Lnczc3h7a与TRIM25和活化的RIG-I结合,在病毒感染的早期阶段用作稳定RIG-I-TRIM25复合物的分子支架。Lnczc3h7a促进TRIM25介导的RIG-1的K63连接的泛素蛋白化,从而促进下游信号转导。研究结果表明,宿主RNA可以增强先天免疫传感器对外来RNA的反应,确保有效的抗病毒防御;
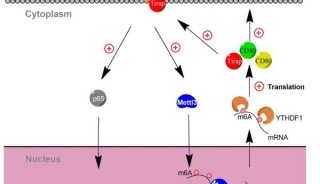
【8】N6-甲基腺苷(m6A)修饰通过调节mRNA生物学在各种细胞反应中起重要作用。然而,m6A修饰如何通过影响免疫转录物的翻译而与先天免疫有关还有待进一步研究。2019年4月23日,曹雪涛团队在Nature Communications在线发表题为“Mettl3-mediated mRNA m6A methylation promotes dendritic cell activation”的研究论文,该研究发现RNA甲基转移酶Mettl3介导的mRNA m6A甲基化促进树突细胞(DC)激活和功能。从机制上讲,Mettl3介导的CD40,CD80和Tirap的m6A增强了它们在DC中的翻译,用于刺激T细胞活化,并增强TLR4 / NF-κB信号传导诱导的细胞因子产生。该研究结果确定了Mettl3介导的m6A修饰在增加某些免疫转录物的翻译中的新作用,用于生理促进DC活化和基于DC的T细胞应答;
【9】2019年3月27日,曹雪涛院士团队在《自然免疫学综述》(Nature Reviews Immunology)(IF41.98)上发表了长达16页的题为“Epigenetic regulation of the innate immune response to infection” 的综述文章;
【10】2019年3月6日,曹雪涛等人在Journal of Experimental Medicine杂志在线发表题为“KAT8 selectivelyinhibits antiviral immunity by acetylating IRF3”的文章,该文章揭示了KAT8和IRF3赖氨酸乙酰化在抑制抗病毒先天免疫中的关键作用;
【11】2019年2月26日出版的新一期《免疫学》(Immunity)杂志刊登了中国工程院院士、南开大学校长曹雪涛研究团队题为“CCR7 Chemokine Receptor-Inducible lnc-Dpf3 Restrains Dendritic Cell Migration byInhibiting HIF1a-Mediated Glycolysis”的研究论文。该研究报道了一种称为lnc-Dpf3的新型长链非编码RNA能通过抑制树突状细胞(DC)体内迁移进而抑制炎症性疾病的发生发展。这也是2019年曹雪涛团队继Nature Medicine、Cellular & Molecular Immunology的第三篇重要研究成果;
【12】2019年1月15日,曹雪涛团队在Nature Medicine在线发表题为“Tumor-educated B cells selectively promote breast cancer lymph node metastasis by HSPA4-targeting IgG”的研究论文,该论文使用乳腺癌自发淋巴结转移的小鼠模型,显示原发性肿瘤在draining淋巴结中诱导B细胞积聚。这些B细胞通过产生靶向糖基化膜蛋白HSPA4的致病性IgG,选择性地促进淋巴结转移,并且在肿瘤细胞中激活HSPA4结合蛋白ITGB5和下游Src / NF-κB途径用于CXCR4 /SDF1α轴介导的转移。研究结果确定了B细胞及其衍生抗体在淋巴结转移前生态位形成中的关键作用,为癌症干预提供了潜在的靶点;
【13】2019年1月11日,曹雪涛团队在Cellular & Molecular Immunology杂志在线发表题为“Intracellular HSP70L1 inhibits human dendritic cell maturation by promoting suppressive H3K27me3 and H2AK119Ub1 histone modifications”的研究论文,该论文证明细胞内HSP70L1通过抑制MHC和共刺激分子表达来抑制人DC成熟,与细胞外HSP70L1的佐剂活性相反。细胞内HSP70L1的稳定性依赖于已知的表观遗传调节因子DNAJC2。该研究结果为细胞内HSP70L1对细胞发育的表观遗传调控提供了新的见解;
1

先天性免疫反应可保护宿主免受病原体感染,并向病原体施加进化压力,以减弱这些反应并确保其存活和复制的策略。这些不断变化的压力导致了跨宿主-病原体相互作用的先天性免疫稳态的复杂机制,但尚未得到全面了解。尤其是,更好地了解控制宿主与病原体相互作用并促进入侵病原体清除或逃逸的调节剂,可以确定传染病和慢性炎症的治疗靶标。
非编码RNA(ncRNA)调节各种先天和适应性免疫过程。 MicroRNA(miRNA)是研究最深入的ncRNA,通常在免疫反应中充当基因表达的转录后调节剂,而长的非编码RNA(lncRNA)已成为各种生理学中基因表达的其他关键调节因子。 LncRNA通过多种机制调节免疫反应和炎症中的信号传导途径,包括充当调节蛋白的向导,支架或诱饵。
核lncRNAs通过支架亚核结构和指导核小体定位来调节免疫反应基因的转录。LncRNA–ACOD1直接与其酶伴侣谷氨酸–草酰乙酸转氨酶2结合,以增强该酶的催化活性,从而促进病毒感染。尽管有这些观察结果,目前尚不清楚调控宿主与病原体相互作用的lncRNA的范围和设置。此外,lncRNA用来调节针对细菌感染的先天免疫应答的多种机制使得难以预测是否以及如何涉及lncRNA。
单核细胞增生李斯特菌是一种细胞内致病性革兰氏阳性细菌,是研究宿主与病原体相互作用和细胞内感染的理想模型。单核细胞增生李斯特氏菌被易感的真核宿主摄取后,便会转变成病原体,以在恶劣的环境中生存。感染的命运取决于巨噬细胞活化与病原体抵抗宿主细胞杀菌能力之间的平衡。 II型干扰素(IFN-γ)通过信号转换器JAK和转录激活因子STAT发出信号,从而具有有效的抗细胞内微生物活性,该转录因子可激活巨噬细胞以对抗细胞内微生物。
为了解决STAT1的数量如何在免疫反应中达到平衡,该研究筛选了单核细胞增生李斯特菌和巨噬细胞之间相互作用的miRNA。研究人员发现,miR-1促进了巨噬细胞中针对细胞内单核细胞增生李斯特菌感染的IFN-γ介导的先天应答。 miR-1在转录后增加Stat1 mRNA的表达,并增强巨噬细胞中的IFN-γ信号传导。在无偏差的miRNA体内沉淀(miRIP)方法中,发现lncRNA Sros1(STAT1的抑制性非编码RNA)被miR-1靶向。 miR-1介导的Sros1降解可稳定Stat1 mRNA,并促进IFN-γ-STAT1介导的先天应答。
总而言之,这些发现揭示了复杂的RNA-RNA调控网络,参与了宿主-病原体相互作用中细胞因子引发的先天反应。
参考消息:
https://www.nature.com/articles/s41590-019-0542-7
2

细胞代谢涉及各种生物过程,包括病毒 -宿主相互作用。在识别或感知入侵病毒后,宿主细胞主动地重新编程代谢,以提供病毒存活的必要组分或抑制病毒复制以进行清除。多个监管机构在病毒 -宿主互动期间参与这些变化。病毒还可以调节宿主代谢途径以完成其生命周期,逃避宿主免疫应答并为持续感染创造有利的细胞微环境。例如,腺病毒感染通过诱导Warburg样转变为有氧糖酵解来改变宿主细胞代谢,从而合成病毒复制所需的蛋白质和核酸。

ALKBH5在体外和体内促进病毒复制,而与先天反应无关
RNA修饰,尤其是最常见的哺乳动物mRNA修饰m6A,可以调节基因表达并调节病毒感染。例如,m6A甲基转移酶复合物成分METTL3 / 14限制黄病毒Zika的产生,而m6A脱甲基酶ALKBH5和FTO增强其产量。

宿主细胞损害ALKBH5介导的RNA m6A去甲基化以抑制病毒复制
在该研究,研究人员报告,响应病毒感染,宿主细胞损害RNA m6A去甲基酶ALKBH5的酶活性。 这增加了α-酮戊二酸脱氢酶(OGDH)mRNA的m6A甲基化,从而降低了其mRNA稳定性和蛋白质表达。减少的OGDH减少了病毒复制所需的代谢物衣康酸的产生。随着体内OGDH和衣康酸产生减少,ALKBH5缺陷小鼠显示出对病毒攻击的先天免疫应答依赖性抗性。该研究结果表明,m6A RNA修饰介导的OGDH-衣康酸途径的下调重新编程细胞代谢以抑制病毒复制,提出了控制病毒感染的潜在靶标。

ALKBH5直接消除OGDH mRNA上的m6A修饰,以增加其稳定性和表达
总而言之,该研究显示OGDH和衣康酸以先天免疫非依赖性方式促进病毒复制,提出靶向OGDH-衣康酸代谢反应以控制病毒感染性疾病。
参考信息:
https://science.sciencemag.org/content/early/2019/08/21/science.aax4468?rss=1
3

通过模式识别受体(PRR)识别病毒核酸可以触发对病毒的宿主先天免疫应答。这导致由干扰素调节因子(IRF)信号传导介导的由NF-κB信号传导和I型干扰素调节的促炎细胞因子的产生。通常,一旦DNA病毒进入宿主细胞,它们就会在宿主细胞核内弹出并复制它们的基因组DNA。然而,在细胞核内识别病原体的DNA的过程仍然是个谜。

hnRNPA2B1激活抗病毒防御以抑制DNA病毒复制
迄今为止,只有一种蛋白质γ-干扰素诱导蛋白16(IFI16)被提出用于识别细胞核内的病毒DNA并激活IFN-I的产生和炎症反应。鉴于宿主细胞经常遇到核病原体衍生的DNA,因此该研究试图鉴定细胞核内其他未表征的IFN-1引发剂。

hnRNPA2B1的二聚化是其核质转运和活化所必需的
已经鉴定出许多能够识别病毒DNA并诱导IFN-α/β产生的蛋白质,如RNA聚合酶III,IFI16,干扰素调节因子(DAI)的DNA依赖性激活剂,LRRFIP1,LSm14A和环状GMP-AMP(cGAMP)合酶(cGAS) )等。然而,只有细胞质cGAS和DNA-PK在功能上被证实为体内DNA传感器。还报道了几种蛋白质参与DNA病毒诱导的炎症反应,包括黑素瘤2(AIM2),IFI16,Rad50和Sox2等。因此,需要更全面地了解针对DNA病毒的先天免疫应答,尤其是关于将病原体衍生的DNA的核识别与细胞质信号传导的激活联系起来的途径。

hnRNPA2B1是cGAS,IFI16和STING有效的I型干扰素诱导所必需的
在该研究,检查了与单纯疱疹病毒-1(HSV-1)的基因组DNA结合的核蛋白,以及在病毒感染后易位至细胞质。该分析揭示了异质核核糖核蛋白A2B1(hnRNPA2B1)作为限制DNA病毒感染的I型干扰素产生的核启动子。在直接识别核病原体衍生的DNA后,hnRNPA2B1易位至细胞质以启动先天免疫应答。然后,hnRNPA2B1同时促进mRNA的核质转运和细胞质表达,例如CGAS,IFI16和STING mRNA,其扩增抗病毒先天免疫信号。总之,这项研究强烈表明,核DNA传感器如hnRNPA2B1是先天免疫防御的重要贡献者。
参考信息:
https://science.sciencemag.org/content/early/2019/07/17/science.aav0758
4

先天免疫细胞检测入侵病原体并发出适当的炎症反应以消除感染。这些细胞表达多种模式识别受体(PRR),如Toll样受体(TLRs),它们可识别病原体相关分子模式(PAMPs)并激活下游信号级联以诱导炎症。 TLR4是一种特异性识别革兰氏阴性菌脂多糖(LPS)的PRR,通过骨髓分化因子88(MyD88)激活NF-κB和丝裂原活化蛋白激酶(MAPK),进而诱导促炎细胞因子的表达。此外,TLR4在识别LPS时被内化到内体中,通过衔接蛋白Toll-IL-1抗性结构域诱导IFN-β(TRIF)和TRAM(TRIF相关衔接子),诱导IRF3依赖性I型IFN产生。然而,先天信号传导诱导有效的先天反应的分子机制需要进一步研究。

Lapf缺陷型巨噬细胞内吞较少的大肠杆菌和金黄色葡萄球菌,并消除较少内吞的大肠杆菌
先天免疫细胞,例如巨噬细胞,树突细胞(DC),单核细胞和嗜中性粒细胞,可通过内吞作用内化入侵病原体。在内化后,病原体成为从早期内体到溶酶体的细胞器的一系列囊泡运输的靶标,其中它们被Mst1-Mst2-Rac信号传导诱导的活性氧物质(ROS)杀死并随后被水解酶降解。然后将来自这些病原体的抗原呈现在主要组织相容性复合物(MHC)分子上,其随后被T细胞受体识别并激活适应性免疫系统的CD4 +和CD8 + T细胞。内吞作用通过多种机制发生,特别是网格蛋白介导的内吞作用,细胞膜内陷介导的内吞作用,巨胞饮作用和吞噬作用。然而,仍然需要充分研究将入侵病原体的内吞作用与先天信号传导的激活联系起来的机制。

Lapf缺陷型小鼠对大肠杆菌感染更敏感,炎性细胞因子较少
Caveolae是一种专门的脂筏,是20世纪50年代首次描述的球形质膜内陷。从那以后,细胞膜内陷广泛参与许多细胞过程,如内吞作用,转胞吞作用(一种特殊形式的内吞作用),脂质稳态和信号转导。细胞膜内陷也参与受体的内吞作用,如TLR4,这是先天免疫反应和信号转导的必要调节机制。细胞膜内陷的主要成分蛋白质是caveolins和cavins。 Caveolin家族由三个成员组成,即caveolin-1(Cav1),caveolin-2(Cav2)和caveolin-3(Cav3)。 Cav1和Cav2在大多数细胞类型中表达。 Cav3在肌肉细胞中特异性表达。细胞膜内陷中的Cav1结合TLR4,内皮型一氧化氮合酶(eNOS),MAPK,环加氧酶(COX)和整合素信号分子,启动不同的信号通路。然而,Cav1在细菌感染中的先天功能及其潜在机制尚未确定。

Src-LAPF-Cav1复合物形成的破坏损害了细菌的内吞作用
该研究发现LAPF(含有PH和FYVE结构域的溶酶体相关和凋亡诱导蛋白)是细胞膜内陷介导的内吞作用所必需的。 Lapf缺陷型巨噬细胞具有内吞和消除细菌的能力受损。巨噬细胞特异性Lapf缺陷小鼠对大肠杆菌(E.coli)感染更敏感,细菌负荷更高。此外,Lapf缺乏损害TLR4内吞作用,导致TLR-触发的促炎细胞因子的产生减弱。LAPF定位于早期内涵体并与caveolin-1相互作用。酪氨酸激酶Src对LAPF的磷酸化是LAPF-Src -Caveolin复合物形成和内吞作用以及细菌消除所必需的。总的来说,该研究表明LAPF对细菌的内吞作用和诱导炎症反应至关重要,这表明LAPF和Src可能是控制传染病的潜在靶标。
参考信息:
https://www.pnas.org/content/116/26/12958.long
5

先天免疫反应是宿主防御入侵病毒的第一道防线。先天受体识别病毒成分并激活下游信号,包括干扰素调节因子3(IRF3)和核因子-κB(NF-κB)途径。转录因子IRF3的激活诱导I型干扰素(IFN-1)的产生,其在宿主防御病毒入侵中起关键作用。上游信号分子(例如,TBK1,IKKε)磷酸化IRF3,引发其二聚化和易位,它可以刺激IFN-1的表达。蛋白磷酸酶2A(PP2A)使IRF3去磷酸化,从而负调节IFN-I的产生。如何精确平衡IRF3的磷酸化和去磷酸化以确保适当的IFN-I产生,同时避免组织先天免疫反应期间的损害尚不完全清楚。
已知表观遗传调节因子在免疫细胞功能的调节以及免疫疾病的发病机制中发挥重要作用。长的非编码RNA(lncRNA)正在成为先天和适应性免疫的关键调节因子。 一些lncRNA直接与染色质修饰因子,异质核核糖核蛋白(hnRNPs)或转录因子相互作用以调节免疫相关基因的转录,而其他lncRNA形成多亚基复合物以调节先天免疫应答途径。细胞质lncRNA已显示通过调节翻译后修饰(PTM)或细胞代谢来控制信号组分的活性。此外,一些差异表达的lncRNA调节炎症先天反应和病原体逃避或宿主期间的存活 -病原体相互作用。 LncRNAs还可以与信号分子相互作用,以控制不同的生物过程。
在先前的研究中,病毒感染诱导IFN-I依赖性lncRNA lnc-lsm-3b和IFN-I非依赖性lncRNA lncRNA-ACOD1的表达,其通过不同机制调节先天反应和病毒复制。该研究鉴定了一种新的细胞质长非编码RNA(lncRNA),lncLrrc55-AS,它驱动正反馈环以促进干扰素调节因子3(IRF3)信号传导和IFN-I产生。
该研究显示lncLrrc55-AS通过IFN-JAK-STAT途径在多种细胞类型中被病毒诱导。LncLrrc55-AS缺陷型小鼠显示出弱化的抗病毒免疫应答,并且更容易受到病毒攻击。机制上,lncLrrc55-AS结合磷酸酶甲酯酶1(PME-1),并促进PME-1与磷酸酶PP2A(IRF3信号传导的抑制剂)之间的相互作用。LncLrrc55-AS支持PME-1介导的去甲基化和PP2A的失活,从而增强IRF3磷酸化和信号传导。PME-1表型缺失,发现lncLrrc55-AS缺失,导致IRF3磷酸化和IFN-I产生减少。总而言之,该研究鉴定出IFN诱导的lncRNA作为IFN-1产生的正调节因子,增加了对先天免疫和炎症中lncRNA介导的信号传导调节的机制洞察。
参考信息:
https://www.nature.com/articles/s41422-019-0193-0
6

作为Toll样受体(TLR),TLR3识别双链RNA(dsRNA)并在先天免疫反应中起关键作用。 TLR3由富含亮氨酸的重复序列(LRR),跨膜结构域和 toll/interleukin-1受体(TIR)结构域。活性TLR3位于内质网(ER)中并保持闭合构象,使其TIR结构域不能被细胞质蛋白质所接近。在识别dsRNA后,TLR3经历从ER到内溶酶体的易位;然后,dsRNA与内溶酶体中的LRR结构域结合,引起TLR3的构象变化和二聚化;紧接着,细胞质中的TIR结构域募集衔接蛋白TRIF,启动下游IRF3和NF-κB信号传导,从而导致I型干扰素(IFN)和炎性细胞因子的转录。

RNF170直接与TLR3相互作用
已发现TLR3在控制病毒感染方面具有保护作用,另外TLR3缺乏与严重的传染病,如疱疹病毒性脑炎有关。然而,TLR3的过度表达也可能由于TLR3介导的炎症反应而引起一些自身免疫性疾病。因此,精确调节TLR3的表达功能对维持免疫稳态和预防相关疾病至关重要。但是,调节TLR3表达和功能的详细机制尚不清楚。
泛素化是在翻译后水平改变蛋白质表达或功能的重要方法,并且已发现其在许多阶段参与先天免疫应答的调节。附着于底物的泛素化蛋白也可以形成不同的多链接并通过不同的机制影响底物的表达或功能。 K48连接的多聚泛素化通过蛋白酶体途径介导底物的降解,而K63连接的多泛素化促进底物的活化。据报道,许多E3连接酶参与TLR3下游信号分子的调节。但是泛素化对TLR3表达或功能以及相关的TLR3结合的E3连接酶的潜在调节作用仍然很大程度上未知。
在本研究中,通过免疫沉淀巨噬细胞中的TLR3相互作用蛋白,研究人员将环指蛋白170(RNF170)鉴定为结合TLR3的E3连接酶。RNF170之前被鉴定为位于ER膜的E3连接酶,其介导-三磷酸肌醇受体的泛素化和降解。然而,尚未鉴定RNF170在先天免疫应答中的底物和功能。在这里,研究人员证明了RNF170促进了TLR3中K766的K48连接多聚泛素化,这导致TLR3通过蛋白酶体途径降解。因此,RNF170抑制TLR3信号传导并抑制TLR3触发的先天免疫应答。
参考信息:
https://www.nature.com/articles/s41423-019-0236-y
7

RNA传感器RIG-I(视黄酸诱导基因I)在宿主防御反应中起着至关重要的作用,可以消除入侵的RNA病毒。感染后,RIG-I C末端结构域识别并结合携带5'-三磷酸(5'-ppp RNA)或5'-二磷酸(5'-pp RNA)的病毒RNA,然后激活至启动下游先天信号传导以诱导I型干扰素(IFN)。RIG-I的不同泛素修饰调节抗病毒免疫反应,例如,E3泛素蛋白连接酶c-Cbl和CHIP通过K48连接的泛素蛋白化促进RIG-I的蛋白酶体降解,其抑制RIG-I依赖性抗病毒信号传导。然而,E3连接酶TRIM25在其两个N-末端半胱天冬酶激活和募集结构域(CARD)中介导RIG-1的K63连接泛素化。K63-泛素蛋白化的RIG-I形成与线粒体抗病毒信号蛋白(MAVS)相互作用的寡聚体,以引发下游信号级联并引发针对RNA病毒的先天免疫应答,包括I型IFNs的产生。
尽管TRIM25在RIG-I介导的抗病毒反应中起关键作用,但调节其抗病毒活性的机制却知之甚少。研究表明,TRIM25受RNA结合调节。登革热亚基因组RNA与TRIM25结合并阻止TRIM25去泛素化,从而负调节RIG-I抗病毒信号通路,使病毒能够逃避宿主抗病毒先天免疫反应。然而,宿主RNA是否通过TRIM25影响抗病毒先天免疫仍不清楚。
长非编码RNA(lncRNA)通过不同的机制在免疫细胞发育和免疫反应中发挥重要作用,包括信号,诱饵,指导或支架作用。先前已经发现了通过直接结合靶蛋白而参与免疫细胞发育和病毒感染的几种lncRNA,例如,lnc-DC通过直接结合促进STAT3磷酸化,因此是树突细胞分化所必需的。然而,在先天免疫应答的早期阶段与关键先天信号分子相互作用以增强抗病毒先天免疫应答的lncRNA需要进一步鉴定。
在这里,研究人员鉴定了先前未描述的lncRNA:Lnczc3h7a,其与TRIM25和活化的RIG-I结合以稳定TRIM25-RIG-I相互作用。有趣的是,Lnczc3h7a在抗病毒反应的早期阶段作为这种相互作用的分子支架,增强了RIG-I和下游信号传导的K63连接泛素化。结果,Lnczc3h7a增加I型IFN产生并支持针对RNA病毒感染的更有效的先天免疫应答。这些发现揭示了宿主(自身)lncRNA在进入外源(非自身)RNA和抗病毒先天免疫应答的强度后,促进先天传感器活化的先前未被认可的作用。
参考信息:
https://www.nature.com/articles/s41590-019-0379-0
8

mRNA的转录后修饰,包括N6-甲基腺苷(m6A),5-甲基胞嘧啶(m5C)和假尿苷(ψ),参与多个细胞过程的表观遗传调控,在影响mRNA稳定性,翻译等过程。作为对哺乳动物mRNA最普遍的转录后修饰,m6A的系统和动态调节由多个writer/eraser组分协调。它主要由含有甲基转移酶样(METTL)酶METTL3和METTL14,Wilms肿瘤相关蛋白(WTAP)的大RNA甲基转移酶复合物催化,其中METTL3负责催化m6A形成; 并通过两种去甲基化酶去除:FTO和α-酮戊二酸依赖性双加氧酶AlkB同系物5(ALKBH5)。

m6A修饰水平在DC成熟中增加
最近,确定了几个属于METTL3-METTL14-WTAP复合体的新成员;据报道RBM15 / RBM15B将该复合物募集到某些mRNA和lncRNA XIST以促进m6A形成;鉴定KIAAI1429和ZC3H3调节m6A甲基化并在不同细胞中发挥不同的功能。此外,一组m6A readers,如YTH-结构域家族(YTHDF)1和YTHDF2,可识别m6A,并分别促进m6A修饰的mRNA的翻译和降解。新出现的证据表明,m6A修饰通过介导RNA衰变来调节多种生物途径,如干细胞分化,肿瘤发生和病毒复制。最近,m6A被证明是宿主免疫细胞区分自身和非自身的重要机制,也可能被病毒劫持以逃避免疫反应;然而,m6A在先天免疫中的这种作用不能用RNA降解机制来解释。因此,需要进一步研究m6A是否通过RNA降解独立机制在哺乳动物细胞中,特别是在免疫细胞中具有其他生理功能。

Mettl3以m6A催化活性依赖性方式促进DC成熟
树突状细胞(DC)是连接先天性和适应性免疫应答的特异性抗原呈递细胞(APC)。DC对于启动适应性免疫应答以消除入侵病原体以及诱导对无害成分的免疫耐受以维持免疫稳态至关重要。DC对免疫激活或耐受的诱导严格依赖于不同成熟阶段的不同DCs亚群。通常,未成熟DC(imDC)诱导免疫耐受,成熟DC(maDC)刺激并激活免疫应答,而调节DC(DCreg)通过抑制T细胞应答下调免疫应答。

Mettl3以m6A催化活性依赖性方式促进T细胞中的DC功能
众所周知,不同阶段DC激活的失调与多种炎症,自身免疫和其他疾病密切相关。虽然已经深入研究了控制DC发育和功能的转录网络,但表观遗传机制,特别是mRNA m6A修饰在该过程中的作用仍有待完全理解。因此,鉴定m6A甲基化在控制DC活化中的作用对于更好地理解免疫应答是至关重要的,并且还将具有重要的临床意义。

Mettl3在DC成熟过程中增强先天反应和NF-κB信号传导
可以通过LPS刺激上调的膜共刺激分子(包括CD40,CD80和CD86)直接调节DC在其抗原呈递和T细胞活化中的功能和阶段是公认的。然而,由于多个细胞可以对LPS刺激作出反应,因此仍然不清楚为什么只有专业的APC(例如maDC)在激活后高度且连续地表达这些共刺激分子以响应先天刺激。imDC,maDC和DCreg的分子谱分析是连续但不同的成熟和分化阶段的三种DC,用于动态研究DC在不同亚群和阶段的免疫激活和调节机制。

Mettl3促进体内Tirap,CD80和CD40 mRNA的翻译
在本研究中,研究人员利用DC成熟和分化模型,包括骨髓来源的imDC,LPS刺激的BMDC(maDC)和DCreg,来研究m6A修饰在DC的成熟和功能中的表达模式和生物学作用。该研究证明mettl3在DC成熟过程中催化CD40,CD80及Tirap的m6A,并且提高它们的翻译效率以促进DC活化和促进T细胞活化的功能。该研究揭示了通过m6A介导的相关免疫转录物甲基化对先天免疫的表观遗传调控。此外,该研究提供了一种新的机制,为什么APC一旦成熟和激活,优先表达更高水平的共刺激分子,以有效地启动免疫反应。
参考信息:
https://www.nature.com/articles/s41467-019-09903-6