比色计对物质颜色的对比及研究
物质的颜色,我们从刚开始的物质,到后来的慢慢的认识,经历了很多的过程,无论在理论上还是在实践上都是一个重要的问题,这种对物质颜色的研究,也为我们带来了很多的便利,诸如隐形飞机的研究就是利用物质颜色的原理。在普通化学、无机化学和分析化学的数学 中也经常接触无机物的颜色。本文借助比色计对物质进行比色测量,然后对物质颜色的产生特点,物质颇色与结构的关系以及无机物颜色的规律进行对比研究和讨论。
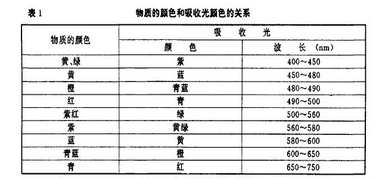
物质的颜色和光是密切联系的。可见光是波长为400nm—760nm的电磁波,不同波长的可见光作用于人的肉眼,其视觉反映的颜色感觉是不相同的。可见光中,各种不同波长的光线反映的颜色称为光谱色,当不同波长的光线同时照射物质时,如完全反射,则该物质为白色;如完全吸收,则该物质为黑色。只有当物质选择吸收可见光线中某一波段的光线,反射其余各波段的光线,物质才是有色的。所以,化合物显色的原因在于它吸收并反射可见光。颜色与物质的结构也是密切联系的。物质吸收光时,化合物的电子在可见光谱中相应能量的光量子的作用下被激发,它的电子能态和基态间的能量差就是所吸收的相应光量子的能量。物质不仅能吸收可见光中具有一定波长的光而本身被激发。而且能散射(向各个不同的方向反射)其他波长的光,其中散射的显色的光,就是被吸收的光的颜色的补色光。物质吸收光的颜色与显色的关系见表1。例如,HgS吸收紫光和蓝光,它所显示的颜色就是它们的补色,即黄绿色。因此,只要化合物的电子的基态和激发态之间的能量差在可见光的能量范围内,物质就能显色。两个能态的能量差愈小,吸收频率愈低(波长愈长)的光,呈现 的颜色就愈深,反之愈浅。如果两个能态的能量差大于可见光的能量,那么,电子由于不能被可见光激发,物质就不呈现颜色。
罗维朋比色计进行比色结果证明,物质是否显色,决定于物质能否吸收可见光;而物质显什么颜色,决定于它们的结构,即决定于基态和激发态的能量差;而颜色的强度则决定于能级跃迁的几率和能级退化性的数目。
前面仅谈了物质显色的原因,那么物质显色的规律又是怎样呢?为此,我们深入到物质的结构,讨论其显色的规律。大多数过渡元素配合物是有颜色的,这是因为在配位体场的影响下,过渡金属离子的d轨道发生了分裂所引起的。对于电子构型不饱满的金属离子,在吸收了一部分光能后,就可以使未成对的电子从低能级的d轨道向高能级的d轨道跃迁,即所谓的d—d跃迁,相当于可见光的波长。作为经验规则:d—d跃迁往往得出浅色,而荷移跃迁则得深色。离子极化对无机化合物的颜色有很大影响,它总是加深化合物的颜色。极化程度愈大,颜色变得愈深。因为离子极化使体系趋于更稳定,能量较高的电子激发态和能量较低的电子的基态都由于极化而降低势能。然而能量较高的激发态轨道半径较大,其极化率也就相应较大,极化对激发态的影响比起基态显得更大,使之降低的能量比基态大得多。因此,离子极化的总效应使激发态与基态更加接近,它们之间的能量差减小,故物质对光的特征吸收就随着极化作 用的加强而向较长波段移动,致使颜色逐步加深。一般说来,比较测色仪显示,离子若无颜色,则所生成的化合物往往也是无色的,离子若有颜色,它的化合物就会有颜色。但常常也有这样的现象,无色离子构成了有色化合物,如无色的Ag+和无色的I—离子生成了黄色的AgI,这是由于离子极化所造成的。这就与阳离子的极化力和阴离子的变形性有关。
最后应当指出,影响无机化合物颜色的因素是比较复杂的,而且影响因素也很多。如物质的聚集状态、分散度、温度、溶解度和微量杂质存在等都会影响物质的颜色。







