中科院生物物理所揭示Chz1识别并组装H2A.Z的分子机制
在真核细胞中,组蛋白变体组装形成特殊的染色质结构,这种与常规组蛋白不同的染色质结构是表观遗传调控的重要方式之一。组蛋白变体H2A.Z与常规组蛋白H2A具有较为相似的一级序列,H2A.Z是多细胞生物的必需基因,且在基因转录调节、DNA损伤修复、细胞增殖、分化等过程中发挥至关重要的作用。近年来,中国科学院生物物理研究所周政研究组综合运用结构生物学和生物化学等方法对组蛋白变体的特异识别进行了系统研究,先后报道了Anp32e识别H2A.Z并将其移除染色质的结构和分子机制(Cell Research 2014),以及染色质重塑复合物亚基YL1识别H2A.Z并帮助其染色质组装的结构和分子机制(Nat Struct Mol Biol 2016)。
5月31日,周政研究组在PLOS Biology 杂志在线发表了题为Structural insights into histone chaperone Chz1-mediated H2A.Z recognition and histone replacement 的研究论文,揭示了酵母组蛋白伴侣Chz1特异性识别组蛋白变体H2A.Z及其促进SWR1催化H2A.Z替换的结构和分子机制。Chz1是最早被发现的能够特异识别组蛋白变体H2A.Z的蛋白分子,也是酵母细胞特有的H2A.Z组蛋白伴侣。Chz1结合酵母细胞中游离H2A.Z-H2B二聚体,并能够促进染色质重塑复合物SRCAP/SWR催化的H2A.Z交换反应。Chz1如何特异性识别H2A.Z?如何通过结合游离的H2A.Z-H2B二聚体促进SRCAP/SWR催化的H2A.Z交换反应?这些关键的科学问题尚未得到解答。
该研究首先测定了Chz1的C末端与H2A.Z-H2B二聚体形成的复合物的晶体结构,ITC实验表明,与此前报道的Chz1结构域(Chz1-M)相比,全长Chz1(Chz1-FL)对H2A.Z的识别特异性得到大幅提高(图1)。其次,研究发现H2A.Z中两个高度保守的氨基酸残基(Gly98和Ala57)对于Chz1特异识别的重要性,从而揭示了一种全新的H2A.Z特异识别机制(图1),这也是第一次在H2A.Z的N端区域发现对于组蛋白特异性识别的位点。最后,SWR1酶活测定发现游离的H2A.Z-H2B二聚体抑制SWR1催化的H2A.Z交换,而Chz1通过结合游离的H2A.Z-H2B解除了这种抑制,从而促进了H2A.Z的交换反应(图2)。
该研究阐明了组蛋白伴侣Chz1特异识别H2A.Z的分子机制,这种新的识别模式与已报道的所有H2A.Z识别模式均不相同,拓展了人们对H2A.Z特异识别机制的理解。该研究还揭示了Chz1通过控制游离的H2A.Z-H2B二聚体的浓度来促进H2A.Z交换的作用方式,上述发现为深入研究H2A.Z奠定了基础(图2)。
周政课题组博士研究生王云云为论文的第一作者,周政为论文的通讯作者。该项工作得到基金委、科技部、中科院B类先导专项的经费支持。约翰霍普金斯大学教授Carl Wu以及纽约州立大学石溪分校教授Ed Luk为该项工作提供了帮助。
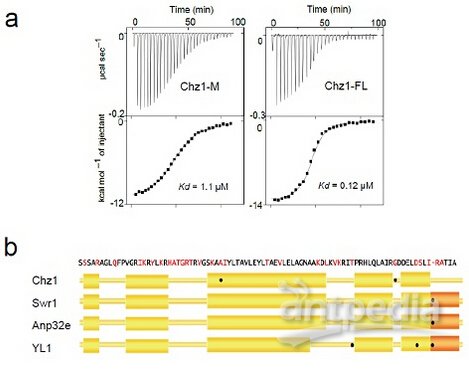
图1 Chz1-FL对H2A.Z的特异识别(a)及H2A.Z上介导识别的关键残基●(b)
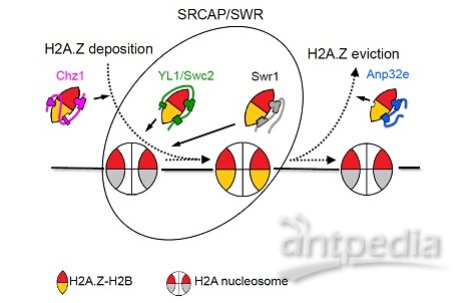
图2 不同分子特异识别组蛋白变体H2A.Z并参与染色质组装和移除的机制