神经生物学领域最新研究进展
本期为大家带来的是神经生物学领域最近的研究进展,希望读者朋友们能够喜欢。
1. Nature:新研究首次揭示抑制年龄相关的神经活动增加竟可延长寿命
doi:10.1038/s41586-019-1647-8.
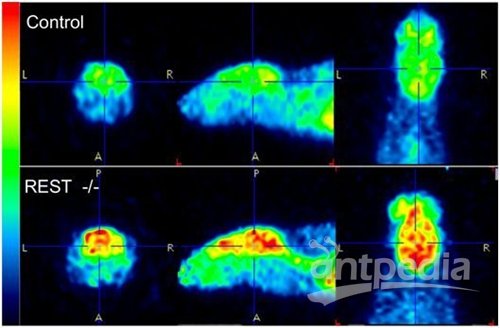
在一项针对线虫、小鼠和人类的研究中,来自美国哈佛医学院的研究人员发现在整个动物界中,衰老会带来更多的神经活动,而当这种自然增加受到限制时,个体的寿命可能就会变得更长。他们着重介绍了一种保守性的称为REST的转录因子,它可能是调节这种年龄相关的神经活动的关键。相关研究结果发表在2019年10月17日的Nature期刊上,论文标题为“Regulation of lifespan by neural excitation and REST”。
美国华盛顿大学圣路易斯医学院发育生物学家Shin-ichiro Imai(未参与这项研究)说,“这是一篇非常有趣的论文,为我们提供了精神食粮。”
在美国韦恩州立大学研究线虫和果蝇衰老的Joy Alcedo(也未参与这项研究)补充说,“这是一个令人着迷的观点:随着人们年龄的增加,我们的神经元可能实际上变得更加活跃,而且简单地抑制这种神经活动可能就足以延长寿命。”
论文通讯作者、哈佛医学院神经学家和遗传学家Bruce Yankner说,随着人们的年龄增长,大脑中的基因表达方式会以非随机的方式发生变化,从而使得年轻人和老年人可通过其转录特征来加以区分。当然,所有老年人都不一样,有些人健康,有些则不那么健康。Yankner及其同事们对某些表达特征是否与这种差异相关感兴趣。
这些研究人员并没有根据健康、寿命或其他任何参数将老年人分为特定的人群,而是让数据来帮助他们。他们获得来自数百名已故的老年受试者的额叶皮层的RNA,并通过一种称为“无监督的分层聚类(unsupervised hierarchical clustering)”的计算过程进行RNA测序读取。在这种计算过程中,计算机迭代地确定谁与谁最接近。他说,结果就是这些RNA转录本数据“自发地分成年龄小于80岁的人和年龄大于85或90岁的人,而且这种分配可在三个不同的队列中观察到,因而具有良好的重复性。”
通过研究这两组之间关键基因表达的差异,这些研究人员发现相比于较早死去的人,寿命较长的人具有更少的参与神经兴奋和突触功能的基因的转录本。
为了让他们的研究超越这种有趣的关联性,这些研究人员转向了动物模型。Yankner解释说,秀丽隐杆线虫是一种非常方便的研究衰老的生物,这是因为“它们的寿命只有三周左右。”他的团队发现,较老线虫的神经元倾向于比较年轻的线虫具有更快的放电速度,但是在寿命显著延长的突变线虫中,神经元活动“几乎保持沉默”。“这是你能想象到的最柔软的线虫。”此外,使用抑制神经活动的药物会使野生型线虫的寿命变得更长。
美国麻省理工学院神经科学家Li-Huei Tsai(未参与这项研究)说:“我个人认为这是一个非常惊人的结果。当你想到寿命时,它是非常神秘的。你可能会认为它可能涉及许多不同的东西。但请注意,[这些研究人员]仅调节一种东西,这就足以改变寿命。”
使用基因工具来关闭线虫中的兴奋性或抑制性神经元,分别会导致更长或更短的寿命,就像增强或抑制一种称为SPR-4的转录因子的水平一样。
SPR-4是线虫中的哺乳动物转录因子REST同源物,其中REST是一种关闭神经基因的转录阻遏物。重要的是,在人类受试者中,与在70岁至80岁之间死亡的人相比,活到100岁或以上的人的REST蛋白水平高得多。而且,在经过基因工程改造而缺乏REST的小鼠中,大脑扫描显示神经活动发生全局性增加。但是,REST对小鼠寿命的影响并未得到研究。
Imai说,“如果这些作者能够发现在增加小鼠大脑中的REST水平时延长它们的寿命,那么这将比线虫研究更接近于人类。”不过,正如他指出的那样,针对能够存活两年或三年的小鼠的寿命实验要比线虫中的困难得多。
Imai说,如果这样的结果能够被证实,并且其机制能够被理解,那么这将为潜在地操纵这种系统打开大门,而且“抗衰老干预措施可能在不久的将来成为现实”。
2. Science:重大进展!揭示基因Shisa7控制着苯二氮平类药物的镇定神经作用
doi:10.1126/science.aax5719.
在1999年至2017年之间,在美国因过量服用安定(Valium,又称为苯甲二氮,或地西泮)和其他苯二氮平类药物死亡的人数增加了10倍。多年以来,科学家们一直认为,这些用于治疗焦虑症、肌肉痉挛和睡眠障碍的强效镇静剂独自地起着镇定神经的作用。如今,在一项新的研究中,来自美国国家卫生研究院(NIH)的研究人员发现这种对这类药物及其影响的神经回路的看法可能必须改变。通过研究小鼠,他们发现这可能需要一个“粘性”基因的帮助,这个基因被命名为Shisa7。相关研究结果发表在2019年10月11日的Science期刊上,论文标题为“Shisa7 is a GABAA receptor auxiliary subunit controlling benzodiazepine actions”
论文通讯作者、美国国家卫生研究院国家神经疾病与卒中研究所(NINDS)研究员Wei Lu博士说:“我们发现Shisa7在对抑制性神经回路的调节和某些苯二氮卓类药物对神经回路活性的镇静作用中起着关键作用。我们希望这些结果将帮助科学家们设计出更有效的治疗方法,以治疗由这些神经回路出现问题而引起的各种神经系统疾病和神经精神疾病。”
Lu实验室研究了用来控制突触的基因和分子。整个神经系统中的神经元之间建立了数万亿个突触或者说通信点。在这项新的研究中,他的团队与美国国家卫生研究院国家儿童健康与人类发育研究所(NICHD)高级研究员Chris J. McBain领导的一个研究团队合作,研究了依赖于神经递质γ-氨基丁酸(GABA)来镇静神经的突触。当一个神经元释放出大量GABA分子时,这些分子随后很快就会相邻神经元表面上称为A型GABA(GABA type A, GABAA)受体的蛋白检测到,这就是不同神经元通过突触进行通信的方式。
在这项研究之前,人们曾认为苯二氮卓类药物单独地起着增强GABAA受体的神经镇静反应。Lu实验室发现,相反,这些反应可能很大程度上取决于Shisa7基因编码的蛋白是否附着在GABAA受体上。虽然这些结果最终可以有助于科学家们更好地了解这类镇静剂,但是这项研究始于一个关于Shisa7的简单问题。
2004年,日本研究人员最初发现Shisa基因在青蛙头部的形成中起作用,并以在日本南部的雕像中描绘的一个神话的大头的保护神的名字命名该基因。
像许多科学家一样,Lu起初认为Shisa7在控制完全不同类型的突触---它们依赖于神经递质谷氨酸来激发而不是镇静神经元---中起着作用。近期的研究表明,Shisa7与其他Shisa基因编码的蛋白附着在谷氨酸受体上。一旦附着上,这些“辅助”蛋白就可以控制谷氨酸受体对谷氨酸的反应或它在突触中的存在。不过,几年前,Lu团队在一篇有关Shisa蛋白的科学文章中注意到了一些有趣的东西。
Lu说,“我们发现了惊人的结果。该文章表明,Shisa7是似乎这个家族中唯一一种对重要类型的谷氨酸受体活性没有影响的蛋白。这引起了我们的注意,我们决定仔细研究一下。”
为此,NINDS博士后研究员Wenwen Han博士与Lu实验室的其他研究人员合作,系统性地研究了小鼠神经元中的Shisa蛋白。令他们吃惊的是,他们发现Shisa7似乎在镇静神经的GABA突触中起着独特而关键的作用。
在NINDS高级研究员Ling Gang Wu博士实验室和美国国家研究院国家聋哑与其他交流障碍研究所(NIDCD)Ronald S. Petralia博士实验室的科学家的帮助下,这些研究人员使用先进的显微镜技术发现Shisa7紧密地簇集位于突触表面的GABAA受体上。通过基因手段剔除神经元中的Shisa7会降低GABAA受体的数量,并降低突触GABAA受体反应产生的电流强度。
进一步的实验表明Shisa7蛋白直接附着于GABAA受体。电记录表明Shisa7加快了GABAA受体对神经递质GABA作出的反应,并使得在存在安定的情况下所产生的反应大小几乎增加了一倍,这表明这种蛋白使得这种受体对苯二氮卓类药物更加敏感。
McBain博士说:“这些结果表明Shisa7在多种条件(包括在苯二氮卓类药物的存在下)下直接形成抑制性突触反应。”
最后,针对小鼠的实验支持了Shisa7也在苯二氮卓类药物的镇静作用中起作用。比如,在一组实验中,他们测试了安定减少小鼠在面对开放的高架空间时感到高度焦虑的能力。为此,他们将小鼠放置在由两个交叉的臂状物组成的高架迷宫的中间。一个臂状物被遮住,另一个臂状物处于开放状态。与先前的研究相一致的是,这些研究人员发现对这些小鼠注射安定会增加野生型小鼠选择在开放臂状物上行走的时间,这表明这种药物减轻了焦虑。相反之下,安定对经过基因改造后缺乏Shisa7基因的小鼠没有影响。不论是接受安定注射还是接受安慰剂注射,这些缺乏Shisa7基因的小鼠花费了相同的时间来探索开放的臂状物。
在其他实验中,这些研究人员发现Shisa7还会影响苯二氮卓类药物的嗜睡和催眠作用。与野生型小鼠相比,缺乏Shisa7的小鼠在接受高剂量安定注射后入睡的可能性要小得多。此外,在安定引起的跌倒后,突变小鼠站起来的能力显著提高,实际上,一些突变小鼠表现出了对跌倒的抵抗力。
Lu说,“我们的结果让人们注意到诸如Shisa7之类的辅助蛋白的潜在临床重要性。我们当前使用的许多神经药物旨在控制突触受体的活性。这是我们首次发现在开发靶向GABAA受体的新疗法时,研究人员可能也想要考虑一下诸如Shisa7之类的辅助蛋白。”
他的团队计划更详细地探究Shisa7在抑制性神经回路和其他神经系统疾病中可能发挥的作用。
3. Cell Rep:特殊蛋白或在神经变性疾病发病中扮演着关键角色
DOI:10.1016/j.celrep.2019.09.013
近日,一项刊登在国际杂志Cell Reports上的研究报告中,来自伦敦大学玛丽女王学院等机构的科学家们通过研究对小鼠进行研究发现一种特殊蛋白或在调节大脑炎症上扮演着关键角色,相关研究或能帮助改善科学家们对神经变性疾病发病机制的理解。
研究者Miguel Burguillos博士表示,当大脑处于压力状态下时,名为TET2的特殊蛋白或能帮助调节大脑中免疫细胞(或小胶质细胞)所产生的免疫反应。尽管神经炎症在抵御机体感染和应对大脑损伤方面具有重要的有益作用,但过度或慢性炎症或会杀死患处周围的神经元细胞,诸如此类神经元的死亡会引发多种神经变性疾病,比如阿尔兹海默病和帕金森疾病等。
研究者指出,从小鼠机体中移除TET2能够有效抑制神经炎性反应;如今研究者知道,TET2能移除来自DNA的特殊化学标记,这种标记能帮助确定基因是否被激活;研究者认为,TET2实际上能够激活大脑中关键的免疫细胞进行表达,与机体其它部位的细胞相比,其在炎性大脑细胞中的表现似乎并不相同。
最后研究者表示,尽管这是一项探索性研究,但相关研究结果为深入研究神经变性疾病开辟了一条新的道路,在这些疾病中,由小胶质细胞所驱动的神经炎症会诱发很多病理学表现,从长远来看,其或能帮助科学家们开发治疗多种神经变性疾病的新型疗法。
4. Neuron:痴呆症在大脑神经网络中传播的新模式
DOI: 10.1016/j.neuron.2019.08.037
在一项新研究中,加州大学旧金山分校的科学家使用脑部连接图谱来预测额颞叶痴呆(FTD)患者脑萎缩的扩散情况,他们提供的最新证据表明,与痴呆症相关的脑细胞的损失是通过突触连接建立的大脑网络而扩散的。该结果提高了科学家对神经退行性疾病如何扩散的认识,并有助于开发新的,有效缓解这类疾病的恶化的疗法以及新型的评估手段。
UCSF神经学助理教授Jesse Brown博士说:“我们的研究揭示了痴呆症如何传播,打开了了解该疾病生物学机制的窗口,即能够找到我们大脑细胞或神经回路的最脆弱的部分”。
FTD是60岁以下人群中最常见的痴呆症类型,其症状体现在语言和行为等方面。与阿尔茨海默氏病一样,FTD症状的多样性反映出神经退行性疾病在患者大脑中的扩散方式存在显著差异。这种差异性使得科学家们难以寻找解决脑萎缩的药物,也难以进行临床试验来评估一种新型疗法是否有效阻止了疾病的恶化。
该研究的资深作者,神经病学和病理学教授William Seeley博士先前的研究揭示了痴呆症患者大脑中多种形式的脑萎缩模式,这一发现极大地影响了痴呆症研究领域。
在他们于10月14日在《Neuron》杂志上发表的新研究中,Seeley及其同事通过研究基于大脑扫描得到的神经网络图,很好地预测了FTD患者脑萎缩的扩散情况。
研究人员招募了42名行为变异性额颞痴呆(bvFTD)患者,这是一种导致患者表现出不良社交行为的FTD患病形式,另外30名患者则具有语义变异的原发性进行性失语症(svPPA),这是主要影响患者语言能力的另外一种FTD形式。在实验开始前,这些患者均接受“基线” MRI扫描,以评估现有大脑退化的程度,然后在约一年后进行随访扫描,以测量其疾病的进展情况。
研究人员首先假设,脑退化始于某些特别脆弱的位置,然后扩散到解剖学上相连的大脑区域。 对此,他们首先估计了每位患者的基线扫描所见的脑萎缩开始部位。然后,他们使用相同的标准化连接图来预测一年后进行的后续扫描中最可能扩散患者脑萎缩的位置,并将这一预测的准确性与其他预测方法的准确性进行比较。
他们发现,两种特殊的连通性测量方法大大提高了他们对给定大脑区域在基线和后续脑部扫描之间出现脑萎缩可能性的预测准确率。一个称为“到震中的最短路径(nodal hazard)”,而另一个称为“节点危害(nodal hazard)”。
研究人员表明,平均而言,这两种网络连通性指标比现有的预测方法更加准确地预测了疾病向新大脑区域的扩散可能性。在许多情况下,该疾病完全绕过了与已经萎缩的区域相邻但在解剖学上不相连的大脑区域,而是跳到了功能连接更紧密的区域。
该发现除了提供了有关FTD扩散脑萎缩的机制的生物学见解之外,还将为开发治疗方法提供信息,例如可以预测科学家们提供有关治疗是否有效改变疾病恶化。研究人员还可以更好地预测萎缩将如何在大脑中扩散,以帮助患者及其家属适应疾病发展过程中可能出现的症状。
5. Neurology:临床试验表明造血干细胞移植可逆转视神经脊髓炎
doi:10.1001/jama.2018.18743.
在一项新的临床研究中,来自美国西北大学费恩柏格医学院和梅奥诊所的研究人员报道造血干细胞移植可逆转一种使人衰弱的神经系统疾病,这种称为视神经脊髓炎(neuromyelitis optica)的疾病导致一半的患者在确诊后5年内失明和失去行走的能力。大多数患者在接受造血干细胞移植5年后保持良好,并且能够避免每年花费高达50万美元的药物治疗。相关研究结果近期发表在Neurology期刊上,论文标题为“Autologous nonmyeloablative hematopoietic stem cell transplantation for neuromyelitis optica”。
视神经脊髓炎,以前被归类为多发性硬化症(MS)的一种罕见亚型,但如今被认为是另一种疾病。与多发性硬化症和大多数其他自身免疫疾病不同的是,视神经脊髓炎具有生物标志物AQP4,它与疾病活动度相关。在造血干细胞移植后,患者的血液中不再具有可识别的AQP4。
论文第一作者、西北大学费恩柏格医学院医学教授、免疫疗法与自身免疫疾病负责人Richard Burt博士说,“之前的治疗方法均未导致AQP4持续消失,或者让患者免于治疗。”
Burt说,“造血干细胞移植和药物治疗之间存在明显的区别。造血干细胞移植改善了患者的神经功能障碍和生活质量。他们的病情好转,而且这种疾病标志物在移植后长达五年的时间里消失了。”
梅奥诊所拥有生物标志物AQP4的ZL,并且与Burt和西北大学合作进行了这种生物标志物分析。
在这项临床研究中,12名视神经脊髓炎患者接受了造血干细胞移植。在移植5年后,在这12名患者中,仅有2人发生疾病复发,不得不重新接受药物治疗。这似乎是造血干细胞移植可以逆转的第四种慢性疾病。
造血干细胞移植的目标是让有缺陷的免疫系统正常运转。造血干细胞取自患者的骨髓或血液,然后他们的免疫系统被化疗彻底摧毁。接下来,将他们的造血干细胞重新引入患者体内,然后它们在体内迁移到骨髓中,从而让他们的免疫系统重置。
Burt开拓了这一领域。他是在医学出版物中第一个提出利用造血干细胞移植治疗多发性硬化症的人,是第一个在临床前动物模型中这样做的人,也是在美国第一个利用造血干细胞移植治疗多发性硬化症患者的人。Burt还针对系统性硬化症和多发性硬化症进行了首批随机造血干细胞移植临床试验,并且取得了非常积极的结果。
2019年1月,Burt在JAMA上发表了一项随机临床研究,它表明在复发缓解型多发性硬化症(relapsing-remitting multiple sclerosis)患者中,造血干细胞移植可逆转神经功能障碍,在5年多的时间里,大多数患者延缓或阻止了进一步的进行性功能障碍,或者出现新的疾病活动的迹象。
根据Burt发表的研究,造血干细胞移植逆转的其他疾病是全身性硬化症和慢性炎性脱髓鞘性多发性神经病(chronic inflammatory demyelinating polyneuropathy)。
6. Front Neurosci: 炎症反应可增强神经元对温度的敏感度
DOI: 10.3389/fnins.2019.01009
近日,北卡罗莱纳州立大学的研究人员发现,炎症会增加小鼠热敏感神经元的活动强度,提高基因表达并促进感觉神经(神经突)生长,但不会增加小鼠的身体感觉。这项工作揭示了炎症诱导的钙通道基因的过度表达在疼痛超敏反应中的作用。
由于多种因素,炎症通常会引起疼痛超敏反应:疼痛受体表达增加;脊髓中神经递质释放的改变;神经元兴奋性增强。研究表明,电压门控钙通道(VGCC)在所有这些变化中都起着重要作用,因为它们释放的神经递质会控制神经元与神经元之间的通讯。
“在炎症状态下,VGCC在感觉神经元过度活跃或过度兴奋中发挥作用。”北卡罗莱纳州立大学分子生物医学科学助理教授,这项工作的主要作者Santosh Mishra说:“另外,由这些通道释放和控制的钙分子调节神经突的生长。我们想更仔细地观察Cav2.2的VGCC的作用,以了解其在炎症过程中是否增加外周神经突的生长。”
在周围的神经系统中,神经元被调节以产生特定的伤害感受信号。例如,TRPV1和TRPM8感觉神经元与热和冷等热感觉相关。另一方面,表达MrgprD和MrgprB4的神经元分别与潜在的损害低阈值机械感觉相关。
Mishra的团队之所以选择Cav2.2,是因为其在背根神经节(DRG)中表达丰富。研究小组使用体外和体内炎症小鼠模型,探究了炎症、Cav2.2活性和传入神经突生长之间的关系。他们发现炎症增加了Cav2.2的表达,而Cav2.2的表达反过来又增加了热敏神经元的传入神经突生长和活性,但没有增加机械神经元的神经突生长。
Mishra说:“机械神经元中Cav2.2通道的表达没有增加,因此对这些神经元没有明显的影响。” “我们不明白的是,为什么炎症不会像热感觉一样在机械感觉中诱导钙通道上调。这可能是因为这些神经元在表达Cav2.2 VGCC时没有那么多,但这是我们需要进一步研究的。”
Mishra希望这项工作将帮助科学家更多地了解慢性疼痛的原因,尤其是炎症引起的周围神经生长变化是否在从急性疼痛状态向慢性疼痛状态的转变中起作用。
这项工作发表在《Frontiers in Neuroscience》杂志上。
7. Nat Commun:新技术可观测到神经突触中的单个蛋白
DOI: 10.1038/s41467-019-12372-6
我们的大脑包含数百万个突触-这些连接在神经元之间传递信息。在这些突触中有数百种不同的蛋白质,这些蛋白质的功能障碍会导致精神分裂症和自闭症等疾病的发生。
最近,麻省理工学院以及哈佛大学和麻省理工学院的研究人员现在已经设计出一种新方法,可以以高分辨率对这些突触蛋白快速成像。使用荧光核酸探针,它们可以标记和观察无限数量的不同蛋白。在这项研究中,他们对含有数千个突触的细胞样本中的12种蛋白质进行了成像。
麻省理工学院生物工程学副教授Mark Bathe说:“多重成像很重要,因为即使在同一大脑内,突触与细胞之间也有很大的差异。”
研究人员计划在下一步使用这种技术来研究突触,以及阻断与特定疾病相关基因的表达时会发生什么,以期希望开发出可以逆转这些效应的新疗法。相关研究发表最近的《nature communications》杂志上。
突触蛋白具有多种功能。它们中的许多有助于形成突触支架,这些支架与分泌神经递质和处理传入信号有关。虽然突触包含数百种这些蛋白质,但传统的荧光显微镜技术仅限于一次最多成像四个蛋白质。
为了增加蛋白质的数量,麻省理工学院的团队基于一种称为DNA PAINT的现有方法开发了一项新技术。使用最初由马克斯·普朗克生物化学研究所的Ralf Jungmann设计的这种方法,研究人员使用DNA抗体探针标记了蛋白质或其他感兴趣的分子。然后,他们通过传递与DNA抗体探针结合的荧光DNA“寡核苷酸”使每种蛋白质能够被观察到。
DNA链彼此之间固有的亲和力很低,因此它们会定期结合和解除结合,可以使用超高分辨率显微镜对闪烁的荧光进行成像。但是,对每种蛋白质进行成像大约需要半小时,因此无法对大型样品中的许多蛋白质进行成像。
Bathe和他的同事着手创建一种更快的方法,使他们可以在短时间内分析大量样本。为了实现这一目标,他们优化了DNA探针,使其可以使用所谓的锁定核酸与DNA抗体更紧密地结合。这样会产生更亮的信号,因此可以更快地完成成像,但分辨率略低。
Bathe说:“当我们在单个神经元孔上进行12或15种颜色处理时,整个实验需要一个小时,而与之相比,此前的技术需要一整夜的时间。
研究人员使用这种技术来标记突触中发现的12种不同蛋白质,包括支架蛋白质,与细胞骨架相关的蛋白质以及已知标记兴奋性或抑制性突触的蛋白质。他们研究的蛋白质之一是shank3,这是一种与自闭症和精神分裂症都有联系的支架蛋白质。
通过分析成千上万个神经元中蛋白质的水平,研究人员能够确定往往比其他蛋白质更频繁地相互关联的蛋白质组,并了解它们所含蛋白质中不同突触的差异。此类信息可用于帮助将突触分类为可能有助于揭示其功能的亚型。
研究人员还表明,他们可以测量河豚毒素(TTX)治疗神经元后发生的突触蛋白水平的变化,这种化合物此前被证明可增强突触连接。
“使用常规的免疫荧光法,通常可以从同一样品中的三个或四个靶标中提取信息,但是通过我们的技术,我们能够将该数目扩展到同一样品中的12个不同靶标。我们将这种方法应用于检查突触重塑TTX治疗后会发生的情况,我们的发现证实了以前的工作,揭示了TTX治疗后突触蛋白的协同上调。”
研究人员现在正在使用这种称为PRISM的技术来研究通过敲除与各种疾病相关的基因如何影响突触的结构和组成。 对自闭症和精神分裂症等疾病患者的基因组进行测序后,发现了数百种与疾病相关的遗传变异,而对于大多数变异,科学家都不知道它们如何导致疾病。
Bathe说:“了解遗传变异如何影响神经元在大脑中的发育以及它们的突触结构和功能,是神经科学领域的巨大挑战。”
8. Nature:首次发现神经胶质瘤与健康的神经元形成突触
doi:10.1038/s41586-019-1563-y.
在一项新的研究中,来自美国斯坦福大学的研究人员首次证实严重的脑癌可整合到大脑的神经连接中。他们发现称为高分级神经胶质瘤的脑瘤会与健康的神经元形成突触,劫持来自健康神经元的电信号,从而促进它们自身的生长。实验表明利用现有的抗癫痫药破坏这些电信号可极大地降低人类肿瘤在小鼠体内的生长,这就为一种潜在地治疗神经胶质瘤的新方法提供了首个证据。相关研究结果于2019年9月18日在线发表在Nature期刊上,论文标题为“Electrical and synaptic integration of glioma into neural circuits”。论文通讯作者为斯坦福大学医学院神经病学与神经科学副教授Michelle Monje博士。论文第一作者为斯坦福大学博士后研究员Humsa Venkatesh博士。
论文通讯作者、斯坦福大学神经病学与神经科学副教授Michelle Monje说,“高分级神经胶质瘤最致命的方面之一是癌细胞扩散性地侵入正常的脑组织,从而让肿瘤和健康的脑组织整合在一起。”她补充说,这一发现有助于解释为什么神经胶质瘤如此难治。“这是一种非常隐蔽的肿瘤类型。它们实际上整合到大脑中。”
Monje说,发现肿瘤将自身连接到大脑中是“令人不安的”。不过,她仍然表示,她对这些知识对神经胶质瘤患者意味着什么持乐观态度。她说,已有几种药物可以治疗癫痫等电信号障碍,这些药物可能对神经胶质瘤有用。她说,“这一发现确实充满希望。我们之前忽略了这种疾病的整个方面。如今,我们有了一条全新的探索途径,可以补充现有的治疗方法。”
脑瘤如何生长
这项新的研究发现高分级神经胶质瘤与健康神经元形成突触,从而将电信号传输到癌变组织。这些肿瘤还包含称为间隙连接(gap junction)的细胞间电连接。这两种类型的连接在一起可以使来自健康神经元的电信号传导到肿瘤中并在肿瘤中放大。
高分级神经胶质瘤包括:胶质母细胞瘤,它是一种成年人中可见的脑瘤,五年生存率为5%;扩散型内因性脑桥神经胶质瘤,它是一种小儿脑肿瘤,五年生存率低于1%;以及其他确诊的高分级神经胶质瘤,比如小儿胶质母细胞瘤和在脊髓和丘脑中发生的弥散性中线神经胶质瘤。Monje及其团队在2015年和2017年发表的研究已表明高分级神经胶质瘤利用正常的大脑活动来驱动它们的生长。
为了了解其中的工作机制,这些研究人员首先分析了从新诊断的神经胶质瘤患者中获取的数千个癌细胞的基因表达。这些癌细胞极大地增加了参与形成突触的基因的表达。
这些研究人员随后使用电子显微镜方法(一种可以揭示细胞解剖结构的微小细节的技术),结果发现神经元和神经胶质瘤细胞之间存在着类似突触的结构。为了证实这些突触确实将健康的神经元和恶性神经胶质瘤细胞连接在一起,他们研究了移植到小鼠大脑中的人神经胶质瘤细胞。在神经胶质瘤肿瘤形成后,他们使用了与这些癌细胞表达的荧光标记结合的抗体,从而确认这些突触进入了这些恶性肿瘤细胞。Monje说,“我们非常清晰地观察到神经元与神经胶质瘤之间形成的突触结构。”
这些研究人员通过使用来自携带人胶质瘤的小鼠的脑组织,测量了电信号进入和通过这种肿瘤的传输情况。他们记录了两种类型的电信号:持续4到5毫秒的短暂信号,这些信号以神经递质分子的方式通过突触连接从健康的神经元传递到癌细胞中;持续一到两秒钟的连续电信号,这些信号反应了钾离子穿过肿瘤细胞的细胞膜时传播的电流。钾离子电流由来自神经元的信号引起,并通过将癌细胞连接到电耦合网络中的间隙连接加以放大。
这些研究人员还使用染料开展实验以可视化观察通过间隙连接连接在一起的细胞, 并使用能够阻断间隙连接的药物来证实这种类似的连接存在于肿瘤细胞之间,并且它们的电耦合。测量钙离子水平变化的进一步实验证实这些肿瘤细胞通过间隙连接电耦合在一起。
Venkatesh说,“实时钙成像清楚地表明了这种癌症是一种电活性组织。在癌症组织中看到这种现象令人吃惊。”
这些研究人员发现大约5~10%的神经胶质瘤细胞会接收突触信号,大约40%的神经胶质瘤细胞表现出长时间的通过间隙连接加以放大的钾离子电流,从而使得一半的神经胶质瘤细胞对来自健康神经元的信号作出某种类型的电反应。
潜在的药物疗法
在通过外科手术移除胶质母细胞瘤之前经测量大脑中具有电活动的人类患者和携带人神经胶质瘤的小鼠中,这些研究人员观察到高度放电性的健康神经元位于肿瘤附近,这一发现可能有助于解释为何神经胶质瘤患者容易出现癫痫发作。
通过使用光遗传学技术,即依赖激光激活对移植人神经胶质瘤的小鼠体内的癌细胞,这些研究人员证实增加进入肿瘤的电信号可导致更多的肿瘤生长。当神经胶质瘤细胞表达一种阻止这些电信号传递的基因时,这能够很大程度上阻止这些肿瘤的增殖。
这项新的研究发现现有的阻断电流的药物也降低了高分级神经胶质瘤的生长。一种称为吡仑帕奈(perampanel)的癫痫药物可阻止突触接收端上的神经递质受体的活性,从而使得移植到小鼠体内的小儿神经胶质瘤的增殖减少50%。甲氯芬那酸(meclofenamate),即一种阻断间隙连接作用的药物,可导致肿瘤增殖发生类似的下降。
Monje团队计划继续研究阻断肿瘤内的电信号是否可以帮助患有高分级别神经胶质瘤的人。她说:“这是一个非常有希望的新方向。作为一名临床医生,我对此感到非常兴奋。”
9. Nat Commun:科学家们在脊椎中发现了新的调节肌肉运动的神经信号
DOI: 10.1038/s41467-019-10822-9
最近一项研究中,通过对海龟神经和肌肉细胞之间的网络进行研究,哥本哈根大学的研究人员对运动产生和维持的方式有了新的认识。从长远来看,这一突破可能会有益于ALS和脊髓损伤的治疗。
来自哥本哈根大学的神经科学系副教授Rune W. Berg等人对神经和肌肉细胞之间的网络进行了研究,提供了有关运动产生和维持方式的全新见解。相关结果发表在最近的《Nature Communications》杂志上。 在这项研究中,研究小组使用电极探究了乌龟用后腿挠时的脊髓反射特征。这一反射在狗,猫和许多其他哺乳动物中也同样存在。
到目前为止,人们普遍认为肌肉神经元的激活源自某种命令中心,该命令中心一次将信号发送给许多细胞。由于很难找到运动的起源,长期以来一直认为这是决定步伐的核心,就像某种节拍器一样。但是,我们的数据表明,它实际上可能是一个庞大的网络。”参与该研究的助理教授HenrikLindén说。
为了测试行走的决定中枢小型核心还是大型网络,研究人员将乌龟运动时相对安静的节奏与脊柱的快速神经冲动进行了比较。令研究小组惊讶的是,这些测量结果没有显示任何相关性。因此,也没有证据表明多个细胞中的神经信号来自同一来源。相反地,研究人员现在认为神经信号源于一个主要的,分散的细胞网络,每个网络仅向少数其他细胞发送信号。该小组随后将结果复制到模拟的简单神经系统的计算机模型中。
有了这些结果,研究人员在精确地了解实际产生运动的位置和方式方面又迈进了一步。``如果我们对网络及其运作方式了解不足,那么在治疗方面我们会摸索不清。相反,一旦我们了解了网络分布背后的原理以及哪些细胞类型很重要,我们就可以更好地将神经系统疾病的治疗放到正确的轨道上,” Rune W. Berg说。
10. Cell:成功绘制出小鼠大脑中1000个神经元的连接图谱
doi:10.1016/j.cell.2019.07.042.
在一项新的研究中,来自美国霍华德休斯医学研究所珍妮亚研究中心的研究人员仔细地解开了1000多个纠缠在一起的神经元,追踪了每个细胞在大脑中的分支路径,以确定它的去向和与哪些细胞连接在一起。他们报道,如果端对端放置的话,这些神经元将伸展80多米,大约相当于两辆校车的长度。相关研究结果近期发表在Cell期刊上,论文标题为“Reconstruction of 1,000 Projection Neurons Reveals New Cell Types and Organization of Long-Range Connectivity in the Mouse Brain”。
两年前,当Jayaram Chandrashekar和他的同事们开始他们的神经制图工作时,神经科学家对哺乳动物大脑中的哪些区域相互交谈有一个大概的想法。但是,大脑中的信息传递架构在很大程度上是一个谜。一种完整的神经回路图可以帮助科学家们更好地理解大脑是如何连接的,以及信息如何通过这种神经回路进行传播。2017年10月,神经元追踪项目团队MouseLight发布了前300个神经元的数据。如今,他们大大扩展了这个数据集,增加了700多个神经元。Chandrashekar说,“这是迄今为止此类神经元的最大数字集合。”
随着时间的推移,该团队简化了他们的神经元追踪过程。首先,他们将病毒注入小鼠大脑,让少数神经元发光。他们随后使用光学显微镜捕获被照亮的神经元的高分辨率图像。计算机程序将2万个形成的图像拼接在一起,从而形成小鼠大脑的三维图谱。Chandrashekar说道,“这就像把两万块乐高积木拼凑在一起。”与霍华德休斯医学研究所珍妮亚研究中心科学计算小组合作开发的算法和软件可以帮助科学家们追踪各个神经元的相互交织的路径。目前,追踪单个神经元大约需要一天,但是在几年前,这需要一到两周的时间。
这些初步数据揭示了关于小鼠大脑如何连接的新线索。在一些大脑区域,神经元聚集成离散的类别。在其他的大脑区域,神经元不能轻易地划分为特定类型。Chandrashekar说,这对于信息在大脑中传播的方式意味着什么还不清楚,但这是未来研究的一个目标。
尽管如此,小鼠大脑(含有大约7000万个神经元)的大部分仍然是未知的荒野。霍华德休斯医学研究所珍妮亚研究中心的Karel Svoboda估计,即使对整个大脑的连接系统有一个模糊的认识---相当于标记重要地标的旅游地图,你也需要追踪大约10万个神经元。
到目前为止,MouseLight一直专注于重建霍华德休斯医学研究所珍妮亚研究中心的科学家们正在研究的一些大脑区域---运动皮层、脑下脚、下丘脑和丘脑---中的神经元。比如,Svoboda使用MouseLight数据识别小鼠中不同的运动控制途径。
不过,该项目仍在不断发展。MouseLight团队在线分享了他们不断扩展的数据集。Chandrashekar希望其他科学家加入他们的神经元追踪工作。
11. Cell:在关键时间窗口内靶向激活PV神经元有望治疗精神分裂症
DOI: 10.1016/j.cell.2019.07.023.
尽管诱发过程发生得更早,但精神分裂症在成年早期出现,这表明它可能涉及易感个体大脑发育后期期间的病理转变。在一项新的研究中,通过使用精神分裂症的遗传小鼠模型,来自瑞士弗雷德里希米歇尔研究所(FMI)的Pico Caroni及其研究团队发现与人类患者一样,特征性的网络和认知缺陷仅在成年小鼠中出现。他们随后证实在青春期后期的敏感时间窗口期间,这些缺陷可通过特定治疗永久性地加以阻止。相关研究结果近期发表在Cell期刊上,论文标题为“Long-Lasting Rescue of Network and Cognitive Dysfunction in a Genetic Schizophrenia Model”。
精神分裂症影响全世界大约1%的人群。它是一种精神疾病,其特征是思想混乱,信念错误,社会关系困难,认知缺陷,运动异常,以及情绪和动机迟钝。这种严重的慢性疾病的一个显著特征是它的症状首先出现在青春期后期和成年早期之间的过渡期。精神分裂症治疗着重关注症状,通常由抗精神病药物组成。
精神分裂症的原因很复杂。它们包括环境因素---比如出生期间的问题、心理社会因素、压力和青春期摄入大麻---和遗传因素作出的类似贡献。在大多数情形下,遗传因素涉及大量基因发生的突变,每个基因突变对这种疾病作出较小的贡献。
为了研究一种具有复杂遗传成分的疾病的根本原因,人们需要尽可能将重点放在更简单的“遗传模型”上,即携带明确确定的突变的人或动物,它/他们表现出较高发病率的风险。在精神分裂症中,此类遗传模型包括患有22Q11DS综合征的人,22Q11DS综合征由22号染色体发生部分片段缺失引起,这些人患精神分裂症的风险增加20~30倍。这导致这些研究人员培育出携带相应缺失的小鼠,以便将它们用作精神分裂症模型用于实验室研究。(这些小鼠被称为“LgDel小鼠”,但为了简单起见,在这里将它们称为“精神分裂症小鼠”。)
通过使用精神分裂症小鼠模型,Caroni团队着手研究精神分裂症小鼠表现出的缺陷,以及如何治疗和预防这些缺陷。他们发现已知在人类患者身上存在的情况在精神分裂症小鼠身上也同样存在:网络和认知功能障碍在青春期后期出现。与人类患者一样,成年小鼠在称为PV神经元的特定类型神经元中显示出严重的功能障碍,其中PV神经元是神经网络的重要协调者。这种功能障碍导致网络同步缺陷,这是精神分裂症的一个标志。值得注意的是,抗精神病药物科暂时抑制成年精神分裂症小鼠的网络和认知缺陷。
尽管PV神经元功能障碍仅在成年时在大脑中扩散,但它们已经存在于处于青春期的精神分裂症小鼠的海马体中。鉴于青春期后期代表一个时间窗口,依赖于海马体和皮质PV神经元的协调活动对于大脑后期成熟很重要,Caroni团队假设青春期时的海马体功能障碍可能干扰精神分裂症小鼠的正常大脑成熟。这些研究人员研究了他们是否可以通过在这个最关键的时间窗口内抑制网络功能障碍来阻止精神分裂症发作,而且尽管存在很强的遗传背景,但是这个时间窗口足够长,足以让成年大脑功能过渡到正常状态。
这些研究人员成功地做到了这一点。他们发现在青春期后期和成年期之间的过渡期间,在6~10天内,用常见的抗精神病药物或特异性的PV神经元遗传激活剂针对海马体PV神经元网络进行重复治疗,可以完全和持久地挽救网络功能障碍,以及成年精神分裂症小鼠的认知缺陷。
Caroni说,“我们在遗传小鼠模型中的研究结果支持这样的一个假设,即一个关键的发育时间窗口会影响精神分裂症在青春期后期和成年期之间的过渡时期的出现---而且可以通过在这个时间窗口期进行治疗来阻止精神分裂症进展。我们有可能在这项研究的基础上开发出治疗策略,以阻止高危人群中的精神分裂症发作。”
-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐
 询底价 Tel:400-6699-117 转 6251
询底价 Tel:400-6699-117 转 6251 -
焦点事件

-
实验室动态

-
焦点事件

-
企业风采

-
焦点事件