模拟移动床色谱技术拆分手性药物
自然界里有很多手性化合物,这些手性化合物具有两个异构体,它们如同实物和镜像的关系,很像人的左右手,通常叫做对映异构体(简称对映体)。两种对映体等量共存称为手性化合物的外消旋体。当某个手性外消旋体进入生命体时,它的两个对映体通常表现出不同的生物活性。人类曾经对此缺少认识,有过惨痛的教训。例如上世纪五十年代开发的一种治疗孕妇早期不适的药物--“反应停”,药效很好,但很快发现服用过“反应停”的孕妇生出的婴儿大多四肢残缺。虽然各国立即停止销售“反应停”,但已造成了数以千计的婴儿畸形。后来发现“反应停”为一外消旋体,其中一种构型对映体有致畸作用,而另一构型对映体没有致畸作用。由此,人们对药物的手性现象开始重视,意识到研究手性化合物对于科学研究以及人类健康有重要意义。
在学术界开展了对手性药物制备技术的广泛研究。一年一度的手性国际会议至今已举办17届。国际著名出版社Wiley Interscience和Ingentaconnect分别出版了关于手性技术的专业期刊Chirality和Enantiomer。2001年10月10日,瑞典皇家科学院将2001年诺贝尔化学奖奖金分别授予美国科学家威廉·诺尔斯、日本科学家野依良治和美国科学家巴里·夏普莱斯,以表彰他们在手性化合物领域所取得的成就。由此可见,手性药物的制备已成为制药学科一个极为重要的发展方向。
许多国家的药政部门也开始加强对手性药物的管理。1992年美国FDA首先公布题为“新立体异构药物开发政策声明”的手性药物法规管理指南,随后欧盟于1994年公布“手性物质研究”的文件。这些措施促进了手性药物的持续增长。从市场销售来看,20世纪90年代以来,手性药物的市场销售迅速增长:1990年的销售额是 180亿美元;1993年为356亿美元,比
1992年增长22%;1997年为910亿美元,比1996年增长21%;1999年为1170 亿美元;2000年为1320亿美元;2001年为1472亿美元;2002年高达1600亿美元。手性药物已成为制药工业一个新的增长点。
我国也已开始重视手性药物的研发。例如国家医药管理局和国家科委生物工程中心在各自的“九五”计划中,列项支持手性药物的不对称合成与拆分技术的攻关。国家自然科学基金委员会近几年来一直优先资助手性科学的研究,1996年国家自然科学基金第一批12个“九五”重大项目中就包括“手性药物的化学与生物学”。2002年1月,中科院上海有机化学所建成全国首家手性药物研究中心,2005年成都有机化学公司组建手性药物国家工程研究中心,2005年5月24~26日首届全国手性药物和中间体技术与市场发展研讨会在浙江嘉兴召开。这些措施促进了我国的手性药物工业的快速发展,但总体来说,仍然缺少创新和基础性研究,与世界手性制药工业的发展有较大差距。因此亟待加强手性技术的研究与开发,跟踪国际最新进展,加强基础研究,开创我国手性制药工业的新局面。
手性药物的制备方法可分为两大类:一类是手性合成法,即直接合成出所需的对映体;另一类是拆分法,即将外消旋体拆分为对映体。由于外消旋体的合成比手性对映体的合成要简便许多,如果配之以拆分法,则采用消旋体合成与拆分联合的路线较为优越。这一路线可以同时得到一对对映体,特别适用于新手性药物的前期开发(这时还不知道哪一种对映体是有效的)。对于已经上市的外消旋药物,则可不必更改其合成路线与工艺,只须拆分即可。
在外消旋体的诸多拆分方法中,最有效的方法应该是模拟移动床色谱分离法。模拟移动床技术是20世纪60年代出现的分离技术,已经用于二甲苯异构体分离、石油馏分中正构烷烃分离、葡萄糖与果糖分离等方面。SMB系统构成如图1所示,多根色谱柱首尾相接成一闭环系统,进料(Feed)和洗脱液(Eluent)入口与萃取液(Extract)和萃余液(Raffinate)出口将之分为四区。每隔一定时间Δt,四股物料的进、出口位置分别沿流动相方向切换至下一根柱子出口(如图1中虚线所示)
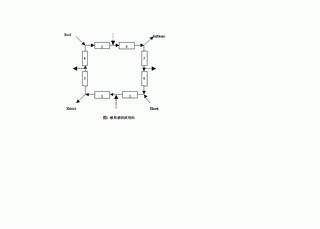
以此实现固定相与流动相之间的逆流效果。选择各区合适的流速与切换时间Δt,即可连续获得两个高纯产品。近十年来,国外一些学者开始尝试将其用于手性物的拆分并获得成功,因其分离过程连续,可提高固定相利用率和流份浓度,并降低流动相消耗,制备成本得到大幅降低,被认为是手性药物制备的首选方法。
模拟移动床分离技术的关键是:1)针对分离对象选定适宜的固定相与流动相配伍。由于手性识别机理的研究还很肤浅,多依靠实验确定固定相与流动相配伍;2)确定最佳的运行条件。因为SMBC分离过程远比间歇式的色谱分离过程复杂,影响分离的参数很多,用传统的实验方法很难确定最佳运行条件。特别是在工业化放大过程中,通过试验来摸索工艺操作条件的投资大、时间长,这些都影响了SMBC技术在工业化生产中的应用。目前多对SMB分离过程建立数学模型,通过模型得到最优操作条件,然后将这些操作条件运用到SMB分离过程中。现主要有两种数学模型:一种是移动床(TMB)模型,就是将SMBC视为移动床(TMB),将柱子切换时间转换为固定相流速,因移动床属于稳态过程,从而得到一组常微分方程,求解较容易。TMB模型只适用于各区柱子数目较多(>3)的情况;另一种是模拟移动床(SMB)模型,它考虑了柱子的切换情况:在任一切换周期内,各个柱子内部为一固定床吸附分离过程,而在柱子切换瞬间,各个柱子内部流量发生变化,但遵循质量守恒关系。SMB模型真实地反映了SMBC的周期性稳态过程特性,因此更为合理。与固定床吸附分离过程相同,从根本上影响模拟移动床色谱分离过程的主要是非线性吸附平衡、传质阻力以及轴向弥散。诸如系统各部件联接处的死体积、色谱柱填充情况、固定相孔径与粒径等孔性结构、各区流速、切换时间、操作温度、进料浓度等各种操作参数之所以影响SMBC分离过程,即是因为这些参数影响轴向弥散、传质过程以及非线性吸附平衡所致。目前所有模型中,均认为各个柱子的轴向弥散和传质过程等相同。事实上,因各区内部流速不同,各区的轴向弥散和传质情况也将有所差异。因未能将这一现象体现到模型中,大多数模型的模拟结果与试验情况误差较大,不能有效的指导模拟移动床色谱分离过程的优化。
此外,虽然模拟移动床色谱分离为一连续稳态过程,但生产过程中,细微的条件变化可能严重影响分离,如色谱固定相在使用过程中性能逐步发生变化,使得分离逐步变差。此时必需即时调整其它相关操作参数以维持有效的分离过程。因而要求模型除能准确预测分离过程外,还需要模型求解速度快,能实现实时控制。这有赖于进一步开发高效的数值计算方法。
SMBC得到的产品是一对光学纯的对映体,通常只有一个对映体具有生理活性,这相当于有一半产品是无效的,目标对映体的理论产率只有50%。因而有必要将无效的非目标对映体外消旋化,然后再用SMBC分离,如此反复进行,使目标对映体的产率接近100%。只有这样才能使SMBC分离技术更具竞争力。与非目标对映异构体一样,目标对映异构体在生产、储运,乃至体内吸收代谢过程中,也可能发生类似的外消旋化现象,这样将削弱手性药物本来具备的优势。必须选择适当的生产、储运条件、药物剂型以及服用方法等,以避免目标对映体的外消化过程。因而研究对映体的外消旋化过程具有十分重要的意义。然而当前这一工作还没得到足够的重视。