帕金森病之SCF蛋白复合物分解α-突触核蛋白聚集物机制
一项新的研究中,来自瑞士苏黎世联邦理工学院、苏黎世大学医院和美国加州大学圣地亚哥分校的研究人员发现了脑细胞用来保护它们自己免受蛋白聚集物损伤的新机制。这一新发现可能为新的治疗方法提供基础。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“A cullin-RING ubiquitin ligase targets exogenous α-synuclein and inhibits Lewy body–like pathology”。
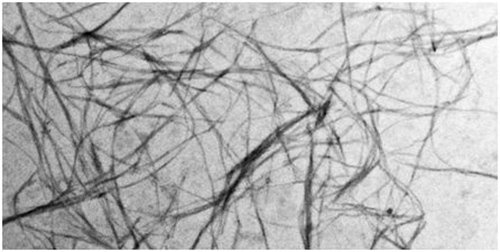
α-突触核蛋白原纤维,图片来自ETH Zurich/Juan Gerez
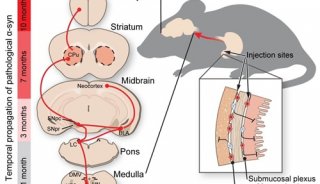
大脑神经细胞中的α-突触核蛋白(alpha-synuclein)聚集物在帕金森病和其他神经退行性疾病中起关键作用。这些蛋白团块能够在神经细胞之间传播,从而导致这种疾病恶化。如今,这些研究人员发现了身体如何摆脱这些破坏性的蛋白聚集物。他们的研究结果可能为治疗神经退行性疾病开辟了新的方法。
与这些疾病相关的是长长的微小纤维或原纤维,大量的α-突触核蛋白分子聚集在这些原纤维上。然而,单个非聚集的α-突触核蛋白分子是健康大脑发挥功能的关键,这是因为这种蛋白在神经细胞突触中释放神经递质多巴胺中起关键作用。当这种蛋白改变它的三维形状,聚集成人神经细胞中的原纤维时,它就不再发挥它的正常功能。这些原纤维也对神经细胞有毒。接着,产生多巴胺的细胞死亡,这就不能给大脑提供充足的多巴胺,从而导致典型的帕金森病临床症状,如肌肉震颤。
破译分解机制
论文共同作者、苏黎世联邦理工学院蛋白网络生物学教授Paola Picotti解释道,“一旦这些原纤维进入新的细胞中,它们就在那里‘招募’其他的α-突触核蛋白分子,后者随后改变它们自己的形状,因而聚集在一起。这就是这些原纤维被认为是一个接一个地感染细胞并随着时间的推移,占据大脑整个区域的方式。”她构想了这项研究。该研究由她的前博士后研究员Juan Gerez领导。
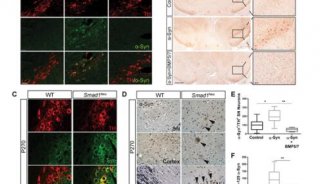
这些研究人员还能够破译一种能够自然地分解α-突触核蛋白原纤维的细胞机制。一种称为SCF的蛋白复合物特异性地检测α-突触核蛋白原纤维并将它们靶向一种已知的细胞分解机制。通过这种方式,这些原纤维的扩散受到阻断,正如他们在小鼠身上开展的实验所证实的那样:当他们关闭SCF的功能时,α-突触核蛋白原纤维不再在神经细胞中受到清除。相反,它们在这些细胞中堆积并在整个大脑中传播。
干细胞或基因治疗
Picotti和Gerez认为这种SCF分解机制有望应用于治疗。Gerez说,“SCF复合物活性越大,就有更多的α-突触核蛋白原纤维受到清除,这可能减缓或最终阻止这类神经退行性疾病的进展。”他接着解释道,SCF复合物存在的时间非常短暂,它在几分钟内就会消散。治疗方法将集中于让这种复合物保持稳定并增加它与α-突触核蛋白原纤维相互作用的能力。比如,可以为此目的开发药物。
Picotti说,另一种帮助帕金森病患者的方法是将神经干细胞移植到他们的大脑中。她解释道,以前的尝试并不是很成功,这是因为大脑中的α-突触核蛋白原纤维感染了这些健康的干细胞。她总结道,“如果我们能够设法修饰这些干细胞,使得它们不让这些原纤维进入,或者它们会立即分解进入它们中的这些原纤维,那么这可能会促进干细胞治疗取得进展。”最后,基因疗法可能用于稳定神经细胞中的SCF复合物,因而增加它的活性。Gerez说道,“然而,当谈到潜在的治疗方法时,我们仍然处于起步阶段。目前还不清楚是否能开发出有效的治疗方法。”
参考资料:
Juan A. Gerez et al. A cullin-RING ubiquitin ligase targets exogenous α-synuclein and inhibits Lewy body–like pathology, Science Translational Medicine (2019). DOI: 10.1126/scitranslmed.aau6722.
-
科技前沿
-
项目成果
-
项目成果

-
项目成果
-
科技前沿