Cell综述丨 十年之后的升级版——细胞自噬与疾病
2016年日本科学家大隅良典(Yoshinori Ohsumi)独获诺贝尔生理或医学奖,获奖理由是在细胞自噬(autophagy)领域所做出的杰出贡献。自从细胞自噬(该概念并非大隅良典首创)这一概念被提出以后,至今已经有将近40000篇文章与其有关。
细胞自噬,是细胞内容物(Cargo)被运输到溶酶体并降解的过程,在正常情况下可以清除细胞内功能异常的蛋白、器官以及微生物。这一过程对维持细胞、组织以及器官的稳态至关重要。细胞自噬受到自噬相关基因(autophagy-related genes, ATG)的严密调控,当这些基因发生突变会诱发一系列疾病包括神经退行性疾病、炎症甚至癌症。那么这些ATG都具有什么样的功能以及与疾病的关系是怎样的?早在2008年,细胞自噬与凋亡领域的两位资深学者Beth Levine就与Guido Kroemer合作在Cell上发表了一篇题为Autophagy in the Pathogenesis of Disease的综述,目前该论文被引次数超过5000次,是自噬领域中的经典综述论文。

如今十年过去了,自噬相关领域的论文又增加了3.3万篇,2016年的诺贝尔生理或医学奖也授予了该领域,相关研究进展已经发生了巨大的变化和进步。2019年新年伊始,Beth Levine与Guido Kroemer合作在Cell上发表了一篇题为Biological Functions of Autophagy Genes: A Disease Perspective的综述【1】,总结了这十年来细胞自噬相关基因功能方面的研究。

根据文章总结,ATG及相关蛋白的功能可以简单的分为七类:
(1)参与自噬溶酶体降解【2】;
(2)参与细胞吞噬【3】;
(3)参与蛋白分泌【4】(非传统的蛋白分泌方式);
(4)参与颗粒分泌【5】,如抗细菌多肽,Cathepsin K;
(5)参与外泌体分泌【6】;
(6)参与代谢过程中的retromer转运【7】;
(7)参与诸如免疫、细胞死亡、细胞周期,维持细胞内稳态,干细胞干性【8】等。
自噬溶酶体降解是ATG最为重要的功能。目前已知参与自噬溶酶体降解途径的大约有16-20个核心ATG蛋白,根据生化特性和功能可以分为五类【9】:
(1)参与自噬启动、磷酸化下游靶点的ULK1丝氨酸苏氨酸激酶复合物,包括ULK1, FIP200, ATG13和ATG101;
(2)参与自噬体成核与成熟的两类Beclin1/PI3KC3复合物(PI3KC3-1: Beclin1, VPS34, VPS15, ATG14; PI3KC3-2: Beclin1, VPS34, VPS15, UVRAG);
(3)唯一的跨膜ATG蛋白(ATG9A),为自噬体提供膜结构;
(4)参与早期自噬体膜延伸的WIPI蛋白及结合蛋白,ATG2A与ATG2B;
(5)参与自噬体膜延伸与完成的两个泛素样蛋白共轭系统:ATG12-ATG5,ATL16L1与LC3亚家族(酵母中为ATG8)。
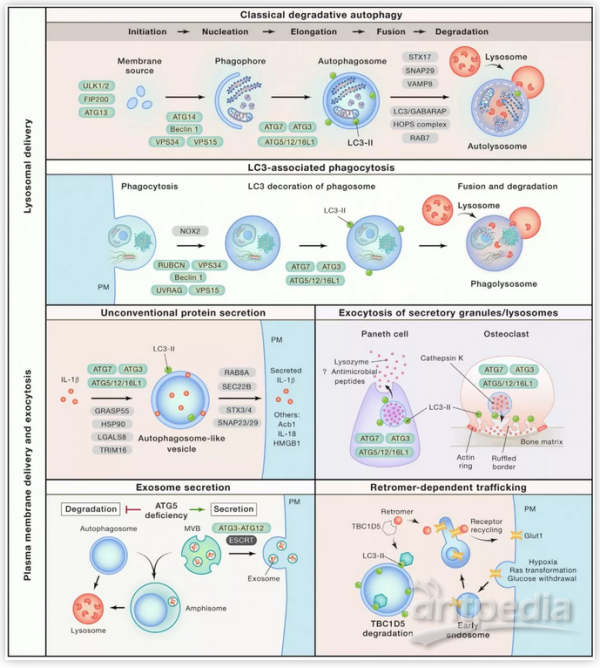
自噬相关基因依赖的膜转运途径(Autophagy Gene-Dependent Membrane Trafficking Pathways)【1】
需要注意的是这种分类并不是绝对的,不同的ATG蛋白结合也会发挥出其他的功能,如ATG13可以通过招募ATG9参与自噬体的结构。另外自噬体不仅需要ATG的参与还需要与溶酶体融合才能完成溶酶体降解。正确的融合需要多因素的参与,包括溶酶体pH改变、细胞骨架马达蛋白、tethering因子(HOPS复合物, Rab GTPase, RAB7),SNARF蛋白,磷脂、LC3/GABARAP家族等。
除了参与自噬,ATG基因如LC3在吞噬(phagocytosis)作用中也扮演了一些角色(LC3-asscociated phagocytosis, LAP)。LAP与自噬的区别在于:
(1)LAP是针对细胞外物质如细菌、死细胞等;
(2)需要细胞外受体参与;
(3)LAP是单层膜,autophagy是双层膜结构;
(4)参与的ATG基因少于细胞自噬。
在分泌方面,ATG基因也发挥了一定的功能,比如参与炎症因子IL-1β与IL-18的分泌(被称为非传统的蛋白分泌方式),但其详细机制有待进一步阐明。
在胞吐方面,ATG蛋白介导了Paneth cell(潘氏细胞或称帕内特细胞,是小肠内一种少见的细胞,提供宿主防卫微生物的侵犯)与osteoclast(破骨细胞)的分泌颗粒的胞吐。该过程依赖于LC3的标记。另外外泌体的分泌也与ATG蛋白相关。比如ATG5可以促进外泌体的分泌从而参与肿瘤的转移。在代谢过程中ATG蛋白与依赖retromer的转运也有关联。以葡萄糖转运蛋白Glut1为例,ATG的缺陷会明显影响Glut1的转运。另外,ATG还与病毒、细菌和其它病原菌的感染有关。例如丙型肝炎病毒在细胞内的RNA复制场所需要ATG蛋白【10】。
除了上述膜运输(membrane trafficking)相关的功能,ATG蛋白还与细胞死亡、细胞周期以及先天免疫有关。
自噬体如何选择性地识别Cargo?一般认为是通过以下三个途径【11】:
(1)Cargo本身带有可与LC3结合的结构域即LIR结构域,在正常情况下LIR被折叠或者受到受到周围氨基酸残基磷酸化的影响保护正常功能的Cargo不被降解;
(2)Cargo首先被泛素等标记,然后通过一个带有可与泛素结合的结构域与LIR结构域的接头蛋白相连;
(3)某些特殊Cargo(与炎症小体或和IFN信号相关的蛋白)与TRIM结合,然后与GABARAP结合。根据Cargo的不同,细胞自噬可以分为aggrephagy, mitophagy, ER-phagy, ribophagy, lysophagy, nucleophagy, lipophagy, xenophagy等。
ATG不仅与细胞自噬中紧密关联,在其它的生物学途径中也发挥出一定的功能,从而在多方面保护机体远离诸如衰老等疾病。当ATG及相关疾病发生突变会导致一系列疾病,其分子机制大概可以分为八个:
(1)调节线粒体自噬的基因(如PARKIN, PINK1)发生突变可以导致遗传性帕金森病;
(2)编码自噬接头蛋白或者激酶的基因(如p62/SQSTM1, TBK)发生突变肌萎缩侧索硬化症等;
(3)溶酶体相关基因突变导致自噬紊乱以及溶酶体储存障碍相关疾病如阿尔茨海默症、帕金森病;
(4)自噬体与溶酶体融合相关基因突变导致先天性神经发育障碍;
(5)Cargo运输相关基因突变导致神经终器蛋白质毒性和变性相关疾病;
(6)核心ATG基因突变导致癌症风险升高;
(7)自噬通路基因突变导致异常的炎症信号;
(8)多基因突变导致一些特殊的疾病如克罗恩病。这些机制的阐述为有效治疗相关疾病打开了曙光,采取有效地干扰手段以恢复突变基因或者其下游基因的正常功能是攻克这些疾病的重点。
参考文献
1. Beth Levine and Guido Kroemer. (2019). Biological Functions of Autophagy Genes: A Disease Perspective. Cell.
2. Dikic, I., and Elazar, Z. (2018). Mechanism and medical implications of mammalian autophagy. Nat. Rev. Mol. Cell Biol. 19, 349–364.
3. Cadwell, K., and Debnath, J. (2018). Beyond self-eating: The control of nonautophagic functions and signaling pathways by autophagy-related proteins. J. Cell Biol. 217, 813–822.
4. Martinez, J., Cunha, L.D., Park, S., Yang, M., Lu, Q., Orchard, R., Li, Q.Z., Yan, M., Janke, L., Guy, C., et al. (2016). Noncanonical autophagy inhibits the autoinflammatory, lupus-like response to dying cells. Nature 533, 115–119.
5. DeSelm, C.J., Miller, B.C., Zou, W., Beatty, W.L., van Meel, E., Takahata, Y., Klumperman, J., Tooze, S.A., Teitelbaum, S.L., and Virgin, H.W. (2011). Autophagy proteins regulate the secretory coponent of osteoclastic bone resorption. Dev. Cell 21, 966–974.
6. Hessvik, N.P., and Llorente, A. (2018). Current knowledge on exosome biogenesis and release. Cell. Mol. Life Sci. 75, 193–208.
7. Roy, S., Leidal, A.M., Ye, J., Ronen, S.M., and Debnath, J. (2017). Autophagydependent shuttling of TBC1D5 controls plasma membrane translocation of GLUT1 and glucose uptake. Mol Cell 67, 84–95 e85.
8. Boya, P., Codogno, P., and Rodriguez-Muela, N. (2018). Autophagy in stem cells: repair, remodelling and metabolic reprogramming. Development 145.
9. Yu, L., Chen, Y., and Tooze, S.A. (2018). Autophagy pathway: Cellular and molecular mechanisms. Autophagy 14, 207–215.
10. Dreux, M., Gastaminza, P., Wieland, S.F., and Chisari, F.V. (2009). The autophagy machinery is required to initiate hepatitis C virus replication. Proc. Natl. Acad. Sci. USA 106, 14046–14051.
11. Kramer, M.H., Farre, J.C., Mitra, K., Yu, M.K., Ono, K., Demchak, B., Licon, K., Flagg, M., Balakrishnan, R., Cherry, J.M., et al. (2017). Active interaction mapping reveals the hierarchical organization of autophagy. Mol Cell 65, 761–774.e5.