肿瘤糖基化可为免疫治疗提供新的免疫检查点
肿瘤的诊断和治疗一直是研究的热点和前沿,其中与免疫相关的诊疗手段更是研究的重点所在。2018年在《Nature Reviews Immunology》上发表了题为《The tumour glyco-code as a novel immune checkpoint for immunotherapy》的综述,深入总结了在肿瘤微环境中肿瘤细胞表面糖基化是如何影响抗肿瘤免疫功能的,并介绍了“糖代码”在发展新的肿瘤诊断和治疗方法中的潜在作用,现介绍如下。

前言
机体的免疫系统在杀伤肿瘤细胞的同时,也增加了肿瘤细胞免疫逃逸的适应性,这种现象被称为免疫编辑。免疫编辑可导致肿瘤侵袭性的增加。肿瘤细胞常表达抑制抗肿瘤免疫应答的分子,如抗炎细胞因子和抑制免疫细胞群浸润性和活性的趋化因子。此外,肿瘤可以表达抑制淋巴细胞受体的免疫检查的分子,并阻断它们的相互作用。
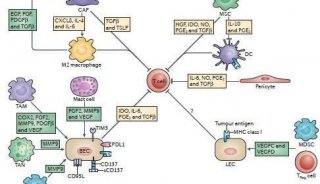
细胞表面糖蛋白和糖脂的糖基化是肿瘤细胞的主要特征之一。与正常细胞相比,肿瘤细胞具有不同的“糖基化涂层”。由于免疫细胞表达大量的不同类型的糖基化依赖性凝集素受体,所以它们能感知自身环境中糖基化标记的变化并做出相应的反应,而这可能会导致免疫抑制。这种诱导的发生是通过免疫系统过表达自身糖基化结构以限制自身活化反应发生或通过表达可以抑制效应T细胞功能的糖基化结构来实现的。糖基化结构如唾液酸等被称为“自相关分子模式”(SAMPS),由固有的抑制受体识别,它们可以维持先天免疫系统非激活状态并抑制其免疫应答的激活。这样,这些分子抵消了病原体相关分子模式(PAMPs)和损害相关的分子模式(DAMPs)(图1)。病原体和肿瘤细胞通过表达宿主来源的糖基化来伪装自己,以此逃避免疫系统的损害。此外,糖基化反应的劫持可以影响抗原提呈细胞的功能,并通过抗炎M2型巨噬细胞,或者改变T细胞分化度和NK细胞活性来促进免疫逃逸。因此,研究肿瘤细胞中“糖代码”的特殊糖基化,对于了解糖基化-凝集素环路在肿瘤微环境中驱动免疫抑制作用是非常重要的。
肿瘤的糖码
糖基化是多种酶共同反应的结果,这些酶能够调节某些糖基化共价结合至蛋白质或脂类。肿瘤相关的糖基化,如唾液酸化结构,Tn抗原(通过糖苷键连接到蛋白质的丝氨酸或苏氨酸的单个残基)和Lewis抗原,常常是膜结合或分泌的肿瘤蛋白的一部分,例如,粘蛋白、癌胚抗原和CD43。此外,肿瘤相关的糖基化还可以附着到膜脂,如神经节苷脂1,神经节苷脂2和神经节苷脂3。细胞的恶性转化伴随着糖基化合成相关基因的改变,如由转录因子、遗传和表观遗传驱动的糖基转移酶和糖苷酶的表达变化,改变了肿瘤的代谢和免疫微环境。
糖基化和肿瘤免疫
有研究表明,凝集素受体,例如唾液酸结合免疫球蛋白样凝集素(SIGLECs),巨噬细胞特异性半乳糖凝集素(MGL)和CD209,它们通过响应肿瘤糖代码介导的免疫抑制来表达(图1)。碳水化合物Lewis抗原可以附着到结肠肿瘤细胞中表达的CEA上,与巨噬细胞和未成熟的DCs中表达的C型凝集素DC-SIGN相结合。因此,在肿瘤微环境中,Lewis结构的富集可以诱导先天免疫抑制。同样,Tn富集MUC1,CD43和CD45或糖脂GM2和GD2,都能在巨噬细胞中与半乳糖凝集素相互作用,诱导以IL-10表达增加和效应T细胞凋亡为特征的免疫抑制。III期结肠癌的患者存活率低与BRAF突变和碳水化合物Tn抗原的表达增多相关。此外,增强的肿瘤细胞唾液酸化作用导致了SIGLECs配体的表达增加。SIGLECs是凝集素受体家族的成员之一,其中大部分的具有免疫抑制功能的(图1)。例如,黑色素瘤细胞的唾液酸化结构与体内肿瘤的生长、Treg细胞的聚集、效应T细胞的低浸润、以及NK细胞的活性都有密切的关联。
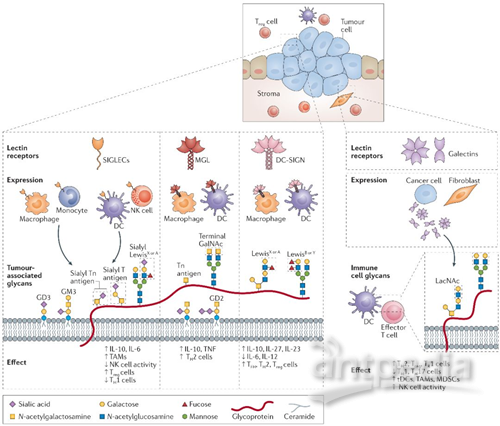
图1.肿瘤的糖基化改变与免疫识别的关系
显然,唾液酸化的结构、Tn和Lewis抗原都有助于形成不同免疫抑制机制的独特糖代码(图2)。有趣的是,糖基化也可以影响一些主要免疫检查点分子的结构和功能。例如,N-糖基化通过减少它的蛋白酶降解来稳定细胞程式死亡-配体1(PDL1),并因此增强其免疫抑制活性。
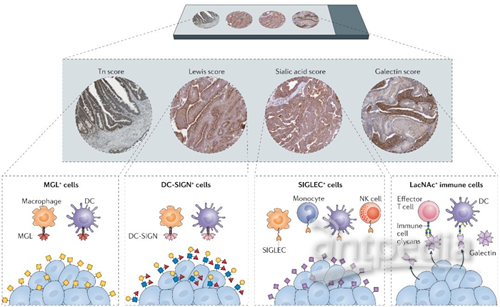
图2.肿瘤病人的肿瘤糖代码分析
外源凝集素在肿瘤细胞的表达
除了异常糖基化表达,肿瘤细胞也可以改变糖基化结合的凝集素的表达。半乳凝素是可溶性凝集素的族群之一,在多种肿瘤细胞中均有分泌。半乳凝素能削弱T细胞的效应,诱导抑制性髓样细胞的分化,并通过与这些免疫细胞群特定的糖基化结合来调节NK细胞活性(图1)。半乳凝素1(GAL1)通过多种机制促进免疫逃逸,包括致耐受性树突状细胞(DC)的分化和诱导辅助性T细胞1和辅助性T细胞17的凋亡。GAL1的表达与肿瘤的转移和侵袭性呈正相关。其他半乳凝素,如GAL3,能使肿瘤特异性T细胞失效。GAL3还通过干扰NK细胞受体D和MHC I类多肽相关序列A(MICA)之间的糖基化依赖性相互作用来降低NK细胞的活性。因此,通过肿瘤分泌的半乳凝素可以作为许多免疫细胞在肿瘤微环境中产生免疫抑制状态的预测指标之一(图2)。
肿瘤诊断中的糖代码
肿瘤细胞的糖基化改变通常发生在肿瘤发展的早期阶段。在不同类型肿瘤的前期病变中,某些的肿瘤相关糖基化的表达已经出现,这使糖基化成为肿瘤早期诊断的一个标志物。鉴于糖基化结构的复杂性和糖基化位点的异质性,如何完整地描述肿瘤糖组学和糖蛋白质组学将是一个难点。
肿瘤相关糖基化
人们可以通过使用针对特定糖基化结构的单克隆抗体来探测与肿瘤相关的糖基化改变(图2)。在临床上,这些抗体可以针对血中糖蛋白表达的特定糖基化,作为肿瘤的生物学标志物(CA153,CA125和CA199)。CA199是一种糖基化结构的唾液酸Lewis A,是在胰腺癌中最广泛使用的血清肿瘤标记物。分析结果显示CA199是早期检测胰腺癌的重要指标。此外,在肿瘤诊断中使用的其它糖基化结构和糖蛋白还包括前列腺特异性抗原(PSA),CEA,粘蛋白和CA724。
凝集素和肿瘤糖代码
凝集素也可以作为肿瘤糖代码的有效评估工具(图2)。迄今为止,已经有数百个来自不同物种的凝集素被研究,这些凝集素均能识别独立的糖基化结构,在临床上可作为新的肿瘤诊断工具。外源凝集素,不仅可以用来分析患者血清中的肿瘤相关标记物,也可以用来分析血细胞的糖基化改变。运用这种方式进行免疫组化和流式细胞仪分析,对肿瘤患者糖代码的系统性研究以及揭示肿瘤微环境的免疫状态都有重要的意义。
抗糖基化疫苗
通常来说,糖基化定位策略主要集中在疫苗的开发和诱导特异性抗多糖免疫反应方面(图3)。例如,以sTN抗原为靶点的癌疫苗能够诱导特异性sTn免疫力的加强,使II期临床试验中转移性乳腺癌患者的存活率显著提高。而III期临床试验中未能有这种发现,这可能是因为在选择人纳入病人之前未对sTn的表达异质性做出评估。因此,对肿瘤患者糖代码的正确的评估不仅有助于免疫诊断,也可以为抗糖基化疫苗接种策略的选择提供依据。
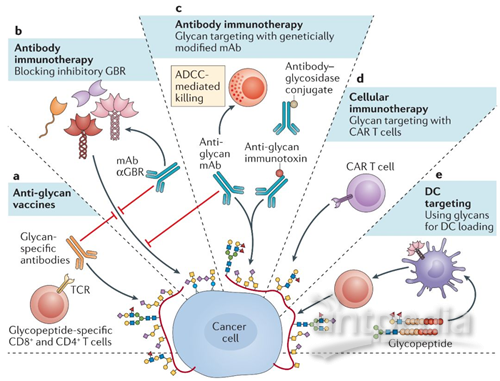
图3.肿瘤糖代码相关的治疗干预
阻断肿瘤相关糖基化和凝集素的相互作用
阻止肿瘤相关糖基化与抑制性免疫受体的相互作用可作为肿瘤的一种治疗方法。目前,能够阻断糖基化和凝集素相互作用的抑制剂已经被广泛应用。糖代码的治疗性修饰,例如使用代谢模拟物或糖苷酶连接到肿瘤靶向抗体来进行唾液酸的阻断,可以抑制肿瘤的生长。这种抑制是由于T细胞介导的抗肿瘤应答和NK细胞活性的增强,这也许是凝集素抑制的结果。采用针对肿瘤糖基化的特异性凝集素受体,选择性抑制糖基化和凝集素的相互作用,可以作为肿瘤的一种新的免疫疗法(图3)。
细胞免疫治疗
肿瘤特异性糖基化TCR反应的发现,有助于肿瘤特异性嵌合抗原受体(CAR)T细胞在临床上的应用。最近,Carl June的研究小组证明了对anti-Tn抗体的单链片段可变区进行克隆产生的TN -MUC-CAR特异性T细胞是治疗小鼠白血病和胰腺癌的有效方法。新的肿瘤特异性糖基化抗体的出现可以大幅度促进CAR T细胞领域的发展。
总结
免疫细胞通过其凝集素受体来编码并翻译肿瘤细胞的 “糖基化信号”,从而导致免疫抑制并促进免疫逃逸。由于一种类型的糖代码能够影响多种免疫细胞,因此想要通过干预肿瘤细胞糖基化来减轻免疫抑制作用,还需要进行更深入的研究。目前的研究表明,在肿瘤细胞上发现的特定糖基化可以被认为是一种新型的免疫检查点,同时肿瘤细胞表面的糖基化也可以作为肿瘤特异性T细胞的靶点。因此,对于一些对免疫治疗反应不佳的患者,肿瘤细胞糖代码的研究和应用将是他们新的希望。
原始文献:
Ernesto RodrÍguez, Sjoerd T. T. Schetters and Yvette van Kooyk. The tumour glyco-code as a novel immune checkpoint for immunotherapy. Nat Rev Immunol. 2018 Mar;18(3):204-211. doi: 10.1038/nri.2018.3.