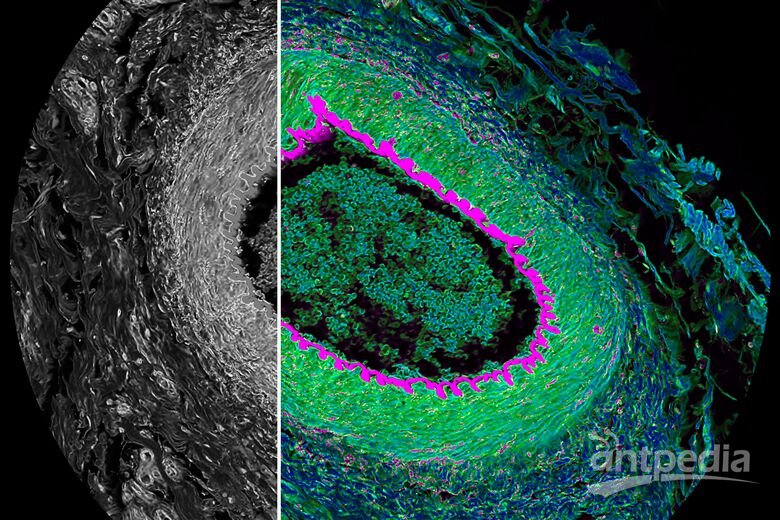
细胞骨架的荧光探针标记方法
细胞骨架主要有微管(micmtuble, MT),微丝(microfilament, MF),中间丝(intermediate filament, IF三种类型。它们分别由不同的蛋白单体组装而成,其中微管蛋白(tubulin)、肌动蛋白(actin)、波形蛋白(vimentin)等是细胞骨架的重要组成部分,也是zui常被研究的细胞骨架蛋白。
1963年.Slauterback采用戊二醛常温固定方法.首先使用电镜在水螅刺细胞中发现了微管。随后,微丝和中间丝相继被发现。它们广泛存在于真核细胞中.细胞骨架蛋白的含量占细胞总蛋白含量的10%-30%。它们与细胞形态的维持,细胞器的空间定位及位置改变.细胞的运动。细胞内的物质运输,细胞内的信号传导,免疫行为和细胞分裂等活动有密切的关系。
一、细胞骨架的荧光探针标记方法
1. 微管蛋白(tubuline)的标记
一般使用间接标记的方法,一抗为抗tubulin单抗,二抗为抗小鼠IgG的荧光抗体,就可以展现出固定细胞,冰冻切片的微管结构。这种小鼠来源的单抗识别微管N端结构域的第69-97个氨基酸残基。同时也是用于ELISA和Western blotting的抗体。检测微管的其他探针有:Bis-ANS是离体状态下微管装配的强抑制剂,荧光探针与蛋白的疏水裂隙结合,且结合后荧光强度增强。用于检测微管蛋白时间和温度依赖性的解聚。DCVJ(4-(dicyanovinyl) julolidine) 用于活细胞微管蛋白装配动态过程的探针。它的作用可被细胞松弛素D(cytochalasin D) 所阻断。
2. 微丝的标记
用鬼笔环肽(phalloidin)标记。鬼笔环肽是从一种菌类Amanita Dhalloides所提取出来的环肽。它与F—actin竞争性的结合。荧光标记的鬼笔环肽在纳克水平就可与F-actin选择性的结合并且易溶于水.为检测组织切片.培养细胞和无细胞体系中的actin的定位和定量提供了非常方便的标记方法。在肌细胞和其他细胞中鬼笔环肽与actin亚单位一比一结合。并且不与G-actin结合。鬼笔环肽比actin的抗体标记有优越性。首先,在不同种类生物中它的结合性质不发生改变。其次.鬼笔环肽标记的非特异性信号可忽略.因而图像的反差较好。
3. 其他细胞骨架蛋白的标记
抗波形蛋白(vimentin)抗体。抗胶质纤维酸性蛋白(GFAP)抗体,抗结蛋白抗体(Anti-Desmin Antibody)等。
二、细胞骨架的共聚焦研究技术
1. 激光共聚焦显微镜的工作原理
激光共聚焦显微镜选用单色性好,单向性好的激光作为光源。激光通过一个照明针孔到达样品,样品只被一个具有精密几何形状的光点照射在焦平面上,只有被照射到的特定点所发射的荧光通过探测针孔到达检测器.该点以外的任何发射荧光均被该针孔阻挡。照明针孔与探测针孔对被照射点或被探测点来说是共轭的.这就是激光扫描共焦显微镜系统中共焦的真正含义。激光共聚焦显微镜利用光电倍增管采集和放大信号。计算机以像点的方式将成像点显示在屏幕上,由光路中的扫描系统在整个样品上扫描.在显示器上产生一幅完整图像。这幅图像即为焦平面的共焦图像。只要载物台沿着Z轴上下移动.将样品新的一个层面移到共焦面上.样品的这个新层面又成像在显示器上。随着Z轴的不断移动.就可得到样品不同层面连续的光切图像。我们将从共聚焦显微镜系统获得的连续光切图像比喻为显微CT,从这些连续的光切图像可通过三维重组模拟出样品真实的立体结构。共聚焦显微镜凭借其特有的成像原理大大提高了分辨率,它在X-Y平面的横向分辨率比普通的显微镜要高出约40%,而且它还可以对厚样本进行非介入无损伤性连续光学切片,得到三维重组的空间立体图像。近十年来,人们已广泛应用CLSM来观察和分析细胞内的微细结构和分子在细胞内的分布,观察细胞内离子,蛋白分子的变化,包括细胞内钙,活性氧,转录因子,表面分子,细胞凋亡,细胞膜流动性,细胞内分子的运动.细胞间的缝隙连接,蛋白间的相互作用等。共聚焦的分析研究已经涉及了生物学的几乎所有领域。
2. 激光共聚焦的图像采集和图像处理与数据分析方法
将制备好的细胞放在荧光显微镜的载物台上进行观察找到需采集的视野,将荧光显微镜转到扫描的位置。根据样品的实际情况.在控制软件的界面中选择图像采集的参数,包括激发光的波长,发射光的范围,扫描模式,扫描速度,探测针孔,电子放大倍数等参数。启动预扫,并调节光电倍增管的电压PMT,Z轴的位置等,调节屏幕的图像的细节清晰锐利,然后采集图像。还可设定z轴的一定范围。按照设定的步距进行光学切片。采集得到的图像还可以通过图像处理和数据分析得到所需要的数据和图像。三维光切的图像可以显示为假三维的叠加图.还可以用软件实现三维重组得到细胞和组织的空间图像。
3.卵细胞纺锤体的激光共焦研究技术
以下就以家兔卵细胞的纺锤体的共焦研究为例来说明细胞骨架共焦研究技术和方法。
1)MII期卵母细胞纺锤体的荧光染色:卵母细胞经以下步骤处理
a. 固定及透化液(2%甲醛+0.1%Triton X-100+1μg/ml taxol),30min。
b. PBS 3次,每次15min。
c. 封闭剂(PBS+2%BSA+2%正常羊血清+2%脱脂奶+0.01%Triton X-100+0.02%叠氮钠+0.1mol/L甘氨酸)4℃隔一晚。
d. 鼠微管蛋白单克隆抗体(mouse monoclonal anti-a-tubulin)孵育30—60min。
e. 封闭液冲洗3次,15-20min/次。
f. FITC标记的羊抗鼠IgG孵育30min, PBS洗3次。
g. 加入PI(碘化丙啶)0.5μg/ml, 10min,PBS洗2次。
所有步骤均在37℃下进行。标本使用LEICA LCSSP2 Laser Scanning Confocal Microscope LCS软件采集和处理图像。
2) 图像采集的仪器条件
物镜采用HCX PL APO CS 63/1.32 OIL UV。双通道采集信号,*通道激发波长为488nm,发射波长为515-535nm。第二通道激发波长为543nm,发射波长为590-630nm。采集模式为xyz,Pinhole为1.60,z轴的总厚度为10.36mm,Z轴以1.4mm为步距连续光切。
三、激光共焦显微镜在细胞骨架研究中的优势
1. 分辨率高.激光共焦显微镜比传统显微镜的分辨率高1.4倍。对于观察细胞骨架等微细结构比传统荧光显微镜优越。共焦显微镜只采集到样品焦平面的像.使细胞骨架的像更加清晰。
2. 激光共焦显微镜实现了对样品的不同层面进行扫描从而产生不同层面的共焦图像。细胞骨架和细胞骨架所形成的一些结构。如纺锤体都具有一定的空间分布.利用激光共焦显微镜可以对这些结构进行无损伤的连续三维光切,形成他们的叠加图像.或经过共焦的图像处理,三维重组得到他们的立体图像。这一点是其他的检测方法所无法做到的。
3. 与电镜相比,标本制备要简便的多,既省时又省力。还可以避免标本制备过程中的假阳性。
综上所述.激光共焦显微镜因为其独特的成像原理决定了它在细胞骨架研究中的重要地位。这项技术的发展为人类更好的认识和研究细胞骨架的功能及其与疾病的关系提供了很好的研究手段。