重磅!冠状病毒首个刺突糖蛋白解析成功
冠状病毒的刺突糖蛋白(Spike glycoprotein, S glycoprotein)是Ⅰ型跨膜糖蛋白,也是病毒最大的结构蛋白,其包含了病毒的主要抗原决定簇,能够刺激机体产生中和抗体和介导免疫反应,通常包括由球状的受体结合亚基S1和棒状的融合亚基S2两部分。同时,S蛋白的S1亚基决定了受体细胞的表面受体的特异性,而S2亚基又决定了病毒进入细胞的融合过程的特性,可以说S蛋白的结构对于设计疫苗来产生抗体或者设计药物阻断病毒吸附与侵染具有重要作用。
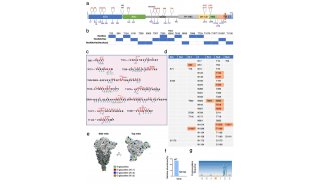
2月15日,美国得克萨斯大学奥斯汀分校Jason S. McLellan教授团队和美国国立卫生研究院NIH联合在预印版网站bioRxiv上发表了首篇使用冷冻电镜解析新冠病毒S蛋白的研究文章。Jason Mclellan团队通过冷冻电镜Cryo-EM技术,解析了新冠病毒S蛋白三聚体的3.5埃的近原子分辨率结构,从生物物理及结构生物学的角度加深了我们对新冠病毒的认知。
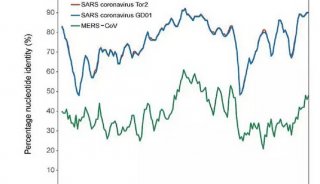
新冠病毒刺突糖蛋白(简称S蛋白)三聚体预融合构象的近原子分辨率结构,其分辨率达3.5埃(10-10 m)。该研究中发现新冠病毒S蛋白三聚体的在多数时候其三个受体结合域(Receptor-binding domains,RBDs)中的一个发生了旋转,使得其更容易与细胞表面的受体相互作用。作者还借助于其他生物物理和负染电镜(Thermo Scientific Talos TEM)技术,发现 2019-nCoV S结合细胞表面受体血管紧缩素转化酶2(angiotensin-converting enzyme 2, ACE2)的亲和力高于SARS-CoV的 S蛋白。这两方面的数据说明了为何2019-nCoV的传染性较其他冠状病毒传染性更强。
通过动力学实验检测确认新冠病毒、SARS病毒与宿主细胞受体ACE2亲和力的差异。令人震惊的是,2019-nCoV结合ACE2的亲和力是SARS病毒结合受体亲和力的10-20倍。该研究成果进一步阐释了新冠病毒能够迅速在人际间传播的原因。
文章链接:仪器设备网 https://www.instrumentsinfo.com/technology/show-3422.html