中外制药新型个性化靶向抗癌药entrectinib在日本申请上市

瑞士制药巨头罗氏(Roche)控股的日本药企中外制药(Chugai)近日宣布,已在日本提交ROS1/TRK抑制剂entrectinib的2份新药申请(NDA)。其中一份NDA申请批准entrectinib用于神经营养性原肌球蛋白受体激酶(NTRK)融合阳性局部晚期或转移性实体瘤成人及儿科患者,包括:既往接受治疗后病情进展的患者,以及作为初始疗法用于没有可接受的标准疗法的患者。另一份NDA申请批准entrectinib用于转移性、ROS1阳性非小细胞肺癌(NSCLC)患者。
中外制药于2018年7月与罗氏达成授权协议,获得了entrectinib在日本市场的开发和商业化独家权益。在美国监管方面,entrectinib正在接受FDA的优先审查,FDA已指定这2份NDA的处方药用户收费法(PDUFA)目标日期为2019年8月18日。之前,entrectinib已分别获美国、欧盟、日本授予突破性药物资格(BTD)、优先药物资格(PRIME)、SAKIGAKE资格(创新药物)。
entrectinib是一种口服、选择性酪氨酸激酶抑制剂(TKI),靶向治疗携带NTRK1/2/3(编码TRKA/TRKB/TRKC)或ROS1基因融合的局部晚期或转移性实体瘤。entrectinib可穿越血脑屏障,阻断TRKA/B/C和ROS1蛋白的激酶活性,导致携带ROS1或NTRK基因融合的癌细胞死亡。entrectinib针对原发性和转移性CNS疾病均具有疗效,并且没有不良的脱靶活性。目前,罗氏正在调查entrectinib治疗多种实体瘤的潜力,包括NSCLC、胰腺癌、肉瘤、甲状腺癌、涎腺癌、胃肠道间质瘤和未知原发癌(CUP)。
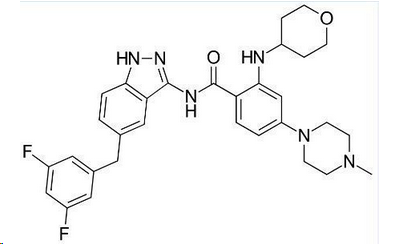
entrectinib分子结构式(图片来源:Wikipedia)
entrectinib NDA基于多项临床研究的整合分析数据,包括II期研究STARTRK-2、3项I期(STARTRK-1、ALKA-372-001、STARTRK-NG)。数据显示:(1)entrectinib在NTRK融合阳性实体瘤患者中的总缓解率(ORR)为57.4%,中位缓解持续时间(DoR)为10.4个月,在基线存在CNS转移患者中的颅内ORR为54.5%;(2)在ROS1阳性NSCLC患者中的ORR为77.4%,中位DOR为24.6个月,在基线存在CNS转移患者中的颅内ORR为55.0%。
entrectinib由Ignyta研制,罗氏在2017年底耗资17亿收购将其收购。目前,罗氏正在利用其开发个体化药物和先进诊断技术方面的专长,与Foundation Medicine在癌症诊疗方面的专长,开发一种基于下一代测序的伴随诊断试剂盒,以筛查出最有可能从entrectinib治疗中获益的癌症患者。
值得一提的是,2018年12月初,拜耳与Loxo Oncology公司靶向抗癌药Vitrakvi(larotrectinib)获得美国FDA批准,用于携带NTRK基因融合的晚期实体瘤儿童和成人患者。此次批准,使Vitrakvi成为有史以来第一个口服TRK抑制剂、第一个与肿瘤类型无关(tumor-agnostic)的“广谱”抗癌药,将开启“tumor agnostic”治疗新纪元。在临床研究中,Vitrakvi治疗的ORR为75%,其中完全缓解率为22%。







