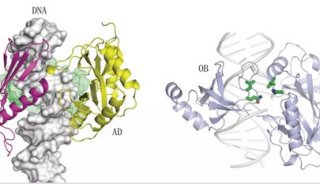
利用蛋白连接酶和切割酶可控地制备聚合蛋白质分子
将多个蛋白质分子交联构建成蛋白二聚体、三聚体甚至多聚体在生物技术、材料和制药等领域有着广泛的应用。以蛋白质为基质的生物材料,具有完美的生物相容性和功能多样性等优势。而在生物制药中,将蛋白类药物分子与其他分子或蛋白交联聚合也有着广泛的应用。目前蛋白聚合主要是利用巯基交联的方式,该反应聚合过程较难调控,得到的产物往往是聚合度不同的多聚蛋白混合物。至于利用蛋白连接酶的交联方式,也存在着连接效率低,聚合度不可控等问题。
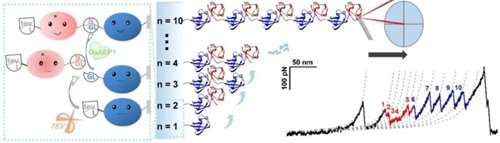
图1. 通过联用蛋白连接酶OaAEP1和蛋白切割酶TEV,我们可以将蛋白质分子从单体逐步交联,分别得到蛋白质二聚体,三聚体,甚至十聚体。通过单分子力谱进行的蛋白质解折叠实验,也在单个分子的层次上证明了该多聚蛋白含有设计的分子个数和正常的结构稳定性,可用于复杂蛋白体系例如金属蛋白的多聚蛋白分子构建和表征
针对这些挑战,近日南京大学化学化工学院配位化学国家重点实验室郑鹏教授课题组通过一种高效的蛋白连接酶(oldenlandia affinis asparaginyl endopeptidases 1, OaAEP1)和一种经典的蛋白切割酶((tobacco etch virus, TEV)的联用,成功地实现了多聚蛋白质分子的可控聚合。从蛋白质单体出发,可以依次分步合成二聚体、三聚体,至十聚体。体系中采用的蛋白酶在不同的pH和多种金属离子的存在下都具有较高的活性,能够广泛地应用到多种蛋白质体系中,特别是那些需要在单体层次上进行提纯,含多个蛋白结构域、分子量过大容易错误折叠,以及含金属离子的复杂蛋白质体系。同时,该连接反应只需要在蛋白质单体的N端和C端,分别引入两个氨基酸GL和三个氨基酸NGL,就可以在二十分钟内迅速完成单步反应,新形成的连接体对蛋白质分子的结构和性质影响极小。而且得到的多聚蛋白可以简单高效进行表面固定化,便于下游的表征和其他各种相关研究。
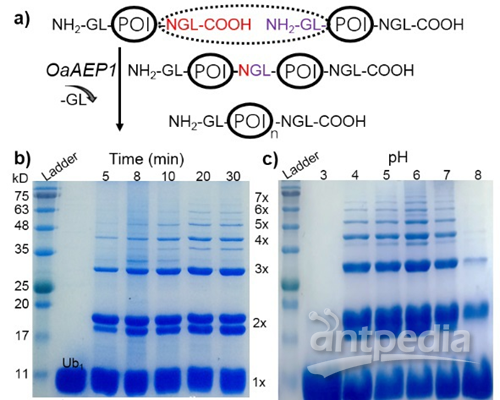
图2. OaAEP1蛋白连接酶催化的反应过程,只需要蛋白单体两端具有GL和NGL的序列(a),该反应迅速,20分钟即可完成(b),在不同的pH下,都具有较高的活性(c)
同时作者采用以原子力显微镜(atomic force microscopy, AFM)为仪器的单分子力谱技术(single-molecule force spectroscopy, SMFS)对得到的多聚蛋白质分子进行了力谱表征。在单个分子的层次下,验证了多聚蛋白内的每个单体都具有和天然单体一致的结构和力学稳定性,不受引入连接序列的影响。另一个方面,我们的方法也为单分子科学研究提供了一种长度可控的多聚蛋白质样品制备方法和样品固定方法。
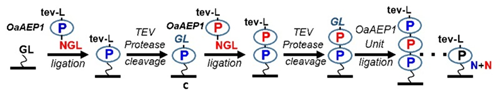
图3.通过OaAEP1蛋白连接酶和TEV蛋白切割酶的联用,蛋白单体可以可控地依次交联,得到需要的多聚蛋白分子
该工作以“Enzymatic Biosynthesis and Immobilization of Polyprotein Verified at the Single-Molecule Level”为题发表在Nature Communications.2019, DOI: 10.1038/s41467-019-10696-x上。直博三年级研究生邓逸冰同学为第一作者,硕士生吴韬同学为第二作者。我校郑鹏教授为唯一通讯作者。此研究得到了国家自然科学基金(21771103)、中央高校基本科研业务费(14380171)、江苏省双创计划和江苏省自然科学基金(BK20160639)和配位化学国家重点实验室等经费的支持。
-
投融资

-
科技前沿
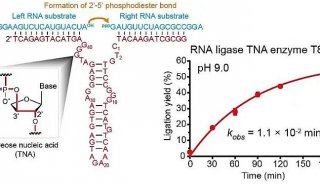
-
项目成果
-
项目成果
-
科技前沿