western blotting的原理、操作步骤及意义
一。免疫印迹法
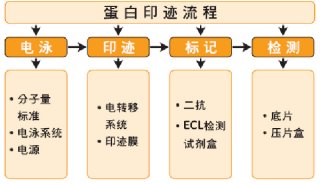
免疫印迹法(immunoblotting test,IBT)亦称酶联免疫电转移印斑法(enzyme linked immunoelectrotransfer blot,EITB),因与Southen早先建立的检测核酸的印迹方法Southen blot相类似,亦被称为Western blot。免疫印迹(western blotting)是在蛋白质电泳分离和抗原抗体检测的基础上发展起来一项检测蛋白质的技术。它将SDS聚丙烯酰胺凝胶电泳的高分辨力与抗原抗体反应的特异性相结合。典型的印迹实验包括三个步骤①蛋白质的电泳分离;②将电泳后凝胶上的蛋白质转移至固体膜上,用非特异性,非反应活性分子封闭固体膜上未吸附蛋白质区域;③免疫学检测。免疫印迹克服了聚丙烯酰胺凝胶电泳后直接在凝胶上进行免疫学分析的弊端,极大地提高了其利用率、分辨率和灵敏度,使其成为使用最广泛的免疫化学方法之一。
第一阶段为SDS—聚丙烯酰胺凝胶电泳(SDS-PAGE)。抗原等蛋白样品经SDS处理后带阴电荷,在聚丙烯酰膪凝胶中从阴极向阳极泳动,分子量越小,泳动速度就越快。此阶段分
离效果肉眼不可见(只有在染色后才显出电泳区带)。第二阶段为电转移。将在凝胶中已
经分离的条带转移至硝酸纤维素膜上,选用低电压(100V)和大电流(1~2A),通电45min
转移即可完成。此阶段分离的蛋白质条带肉眼仍不可见。第三阶段为酶免疫定位。将印
有蛋白质条带的硝酸纤维素膜(相当于包被了抗原的固相载体)依次与特异性抗体和酶
标第二抗体作用后,加入能形成不溶性显色物的酶反应底物,使区带染色。常用的HRP
底物为3,3,—二氨基联苯胺(呈棕色)和4-氯-1-萘酚(呈蓝紫色)。阳性反应的条带清晰
可辨,并可根据SDS-PAGE时加人的分子量标准,确定各组分的分子量。本法综合了
SDS-PAGE的高分辨力和ELISA法的高特异性和敏感性,是一个有效的分析手段,不仅
广泛应用于分析抗原组分及其免疫活性,并可用于疾病的诊断。在艾滋病病毒感染中此
法作为确诊试验。抗原经电泳转移在硝酸纤维素膜上后,将膜切成小条,配合酶标抗体
及显色底物制成的试剂盒可方便地在实验室中供检测用。根据出现显色线条的位置可判
断有无针对病毒的特异性抗体。
Westernblot 实验步骤及注意事项
一.实验步骤
1. 组织块称重
2. 利用液氮、研钵粉碎组织块
3. 加入RIPA缓冲液(每克组织3 ml RIPA),PMSF(每克组织30μl,10 mg/ml PMSF),利用Polytron进一步匀浆(15,000转/分*1分钟)维持4℃
4. 加入PMSF(每克组织30μl,10 mg/ml PMSF),冰上孵育30分钟
5. 移入离心管4℃ 约20,000 g(约15,000转)15分钟
6. 上清液为细胞裂解液可分装-20℃保存
7. 进行Bradford比色法测定蛋白质浓度
8. 取相同质量的细胞裂解液(体积*蛋白质浓度),并加等体积的2×电泳加样缓冲液
9. 沸水浴中3分钟
10. 上样
11. 电泳(浓缩胶20mA,分离胶35mA)
12. 电转膜仪转膜(100mA 40分钟)
13. 膜用丽春红染色,胶用考马斯亮蓝染色
14. Westernblot 试剂盒显色
15. 分析比较记录
western blot的实验步骤及注意事项的资料
1. 把聚丙烯酰胺凝胶中的蛋白质电泳转移到硝酸纤维膜上。
1)转移缓冲液洗涤凝胶和硝酸纤维素膜,将硝酸纤维素膜铺在凝胶上,用5ml移液管在凝胶上来回滚动去除所有的气泡。
2)在凝胶/滤膜外再包一张3mm滤纸(预先用转移缓冲液浸湿),将凝胶夹在中间,保持湿润和没有气泡。
3)将此滤纸/凝胶/薄膜滤纸按照厂家建议方法放入电泳装置中,凝胶面向阴极。
4)将上述装置放入缓冲液槽中,并灌满转移缓冲液以淹没凝胶。
5)按照厂家所示接通电源开始电泳转移。
6)转移结束后,取出薄膜和凝胶,弃去凝胶。
2. 将薄膜漂在氨基黑中快速染色,直至分子量标准显现时取出,记录下标准位置。
3. 用100ml水洗涤纤维素膜,必要时可用脱色缓冲液。
4. 膜置印迹缓冲液中于37℃保温1小时。
5. 室温下,用PBS-Tween缓冲液洗涤薄膜。
6. 用封口机将薄膜封入塑料袋中,尽可能不留空气。
7.袋的一角剪一缓冲液的小口,用透析袋夹紧。
8.混合:NGS(100微升),印迹缓冲液中的抗体(10毫升),加在装薄膜的袋中,于室温下摇动2小时(或4℃过夜)
9.用总体积300ml PBS-Tween缓冲液,分4次在一浅盘中洗涤薄膜,每次75ml。
10. 将连接生物素的羊抗兔IgG(40微升溶于10毫升印迹缓冲液/100微升 NGS)加在袋内,于室温下摇动1小时。
11.按步骤9洗涤。
12.加入抗生素蛋白-HRP(40微升溶于10毫升印迹缓冲液/100微升 NGS),于室温下摇动。
注意事项:
western blot中转移在膜上的蛋白处于变性状态,空间结构改变,因此那些识别空间表位的抗体不能用于western blot检测。这种情况可以将表达目的蛋白的细胞或细胞裂解液中的所有蛋白先生物素化,再用酶标记亲和素进行western blot。实验中取胶和膜需带手套。
Western可以参考如下步骤进行操作。
1.收集蛋白样品(Protein sample preparation)
可以使用适当的裂解液,例如碧云天生产的Western及IP细胞裂解液,裂解贴壁细胞、悬浮细胞或组织样品。对于某些特定的亚
细胞组份蛋白,例如细胞核蛋白、细胞浆蛋白、线粒体蛋白等,可以参考相关文献提取这些亚细胞组份蛋白,也可以使用试剂盒
进行抽提,例如碧云天生产的细胞核蛋白与细胞浆蛋白抽提试剂盒。
收集完蛋白样品后,为确保每个蛋白样品的上样量一致,需要测定每个蛋白样品的蛋白浓度。根据所使用的裂解液的不同,需要
采用适当的蛋白浓度测定方法。因为不同的蛋白浓度测定方法对于一些去垢剂和还原剂等的兼容性差别很大。如果使用碧云天生
产的Western及IP细胞裂解液,可以使用BCA蛋白浓度测定试剂盒。
2. 电泳(Electrophoresis)
(1) SDS-PAGE凝胶配制
SDS-PAGE凝胶可以参考一些文献资料进行配制,也可以使用碧云天生产的SDS-PAGE凝胶配制试剂盒。该试剂盒提供了除水和配
胶器具外的所有试剂以及配制各种浓度SDS-PAGE的配方。
(2) 样品处理
在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。例如2X或5X的SDS-PAGE蛋白上样缓冲液。使用5X的SDS-PAGE蛋
白上样缓冲液可以减小上样体积,在相同体积的上样孔内可以上样更多的蛋白样品。5X的SDS-PAGE蛋白上样缓冲液可以参考相关文献资料配制,也可以使用碧云天生产的SDS-PAGE蛋白上样缓冲液(5X)。
100℃或沸水浴加热3-5分钟,以充分变性蛋白。
(3) 上样与电泳
冷却到室温后,把蛋白样品直接上样到SDS-PAGE胶加样孔内即可。
为了便于观察电泳效果和转膜效果,以及判断蛋白分子量大小,最好使用预染蛋白质分子量标准。
电泳时通常推荐在上层胶时使用低电压恒压电泳,而在溴酚蓝进入下层胶时使用高电压恒压电泳。对于Bio-Rad的标准电泳装置
或类似电泳装置,低电压可以设置在80-100V,高电压可以设置在120V左右。SDS-PAGE可以采用普通的电泳仪就可以满足要求,
也可以采用碧云天的多功能电泳仪(带定时)。为了电泳方便起见,也可以采用整个SDS-PAGE过程恒压的方式,通常把电压设置在
100V,然后设定定时时间为90-120分钟。设置定时可以避免经常发生的电泳过头。
通常电泳时溴酚蓝到达胶的底端处附近即可停止电泳,或者可以根据预染蛋白质分子量标准的电泳情况,预计目的蛋白已经被适
当分离后即可停止电泳。
3. 转膜(Transfer)
我们推荐在Western实验中选用PVDF膜。硝酸纤维素膜(NC膜)也可以使用,但硝酸纤维素膜比较脆,在操作过程中特别是用镊子
夹取等过程中容易裂开。膜的使用请参考生产商的推荐使用步骤。
通常如果使用Bio-Rad的标准湿式转膜装置,可以设定转膜电流为300-400mA,转膜时间为30-60分钟。也可以在15-20mA转膜过
夜。转膜时也可以使用碧云天的多功能电泳仪(带定时)。具体的转膜时间要根据目的蛋白的大小而定,目的蛋白的分子量越大,
需要的转膜时间越长,目的蛋白的分子量越小,需要的转膜时间越短。
在转膜过程中,特别是高电流快速转膜时,通常会有非常严重的发热现象,最好把转膜槽放置在冰浴中进行转膜。
转膜的效果可以观察所使用的预染蛋白质分子量标准,通常分子量最大的1-2条带较难全部转到膜上。转膜的效果也可以用丽春
红染色液对膜进行染色,以观察实际的转膜效果。也可以用考马斯亮蓝快速染色液对完成转膜的SDS-PAGE胶进行染色,以观察蛋
白的残留情况。
4. 封闭(Blocking)
转膜完毕后,立即把蛋白膜放置到预先准备好的Western洗涤液中,漂洗1-2分钟,以洗去膜上的转膜液。从转膜完毕后所有的步
骤,一定要注意膜的保湿,避免膜的干燥,否则极易产生较高的背景。
用微型台式真空泵吸尽洗涤液,加入Western封闭液,在摇床上缓慢摇动,室温封闭60分钟。对于一些背景较高的抗体,可以在
4℃ 封闭过夜。在整个Western过程中我们推荐使用碧云天生产的侧摆摇床,侧向摆动速度比较缓慢,而且也容易让溶液覆盖蛋
白膜。
5. 一抗孵育(Primary antibody incubation)
参考一抗的说明书,按照适当比例用Western一抗稀释液稀释一抗。
用微型台式真空泵吸尽封闭液,立即加入稀释好的一抗,室温或4℃在侧摆摇床上缓慢摇动孵育一小时。如果一抗孵育一小时效果
不佳,可以在4℃缓慢摇动孵育过夜。
回收一抗。加入Western洗涤液,在侧摆摇床上缓慢摇动洗涤5-10分钟。吸尽洗涤液后,再加入洗涤液,洗涤5-10分钟。共洗涤
3次。如果结果背景较高可以适当延长洗涤时间并增加洗涤次数。
6. 二抗孵育(Secondary antibody inucubation)
参考二抗的说明书,按照适当比例用Western二抗稀释液稀释辣根过氧化物酶(HRP)标记的二抗。
用微型台式真空泵吸尽洗涤液,立即加入稀释好的二抗,室温或4℃在侧摆摇床上缓慢摇动孵育一小时。
回收二抗。加入Western洗涤液,在侧摆摇床上缓慢摇动洗涤5-10分钟。吸尽洗涤液后,再加入洗涤液,洗涤5-10分钟。共洗涤
3次。如果结果背景较高可以适当延长洗涤时间并增加洗涤次数。
7. 蛋白检测(Detection of proteins)
参考相关说明书,使用BeyoECL, Western 荧光检测试剂等ECL类试剂来检测蛋白。
洗片时可以使用X光片自动洗片机。如果没有自动洗片机,可以用显影定影试剂盒自行配制显影液和定影液进行手工洗片。
8. 膜的重复利用(Membrane recovery)
如果蛋白样品非常宝贵,可以使用Western一抗二抗去除液处理蛋白膜,以重复利用蛋白膜。