蛋白质胰蛋白酶磷酸肽图谱制定实验——固相蛋白消化
| 试剂、试剂盒 | |
|---|---|
| 仪器、耗材 | |
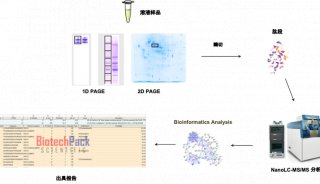
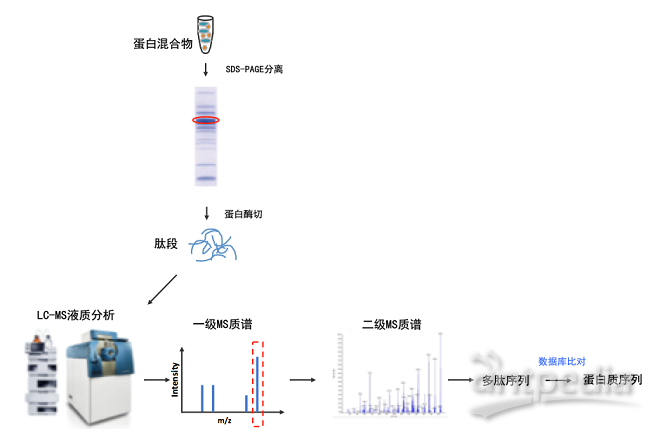
| 实验步骤 | 1. 用 SDS-PAGE 凝胶电泳分离 32P 标记的样品,用标准的湿式或半干式蛋白质转移方法将蛋白质转移到 PVDF 或硝酸纤维素膜上。 2. 将膜晾干并用保鲜膜或聚酯薄膜包裹以防止膜与胶片粘连,用荧光墨水做标记(见基本方案步骤 2), 对 X 射线胶片曝光(放射自显影)。 3. 比对胶片和膜上的荧光标记的位置以确定蛋白质在膜上的位置(见基本方案步骤 3)。 4. 用单边的剃刀刀片割下含有所要的蛋白质的膜条,然后将此膜条切成更小的碎片。 将这些含有特定的磷酸标记蛋白的膜碎片装入一个微量离心管中。用契仑科夫计数法对膜碎片的放射性进行定量测定。 5. 加入 500 μl 甲醇重新浸湿膜碎片,用去离子水洗涤膜片数次,然后于 0.5% PVP-360(溶于 100 mmol/L 乙酸)中 37 ℃ 孵育 30 min。 6. 洗膜至少 5 次,每次用 1 ml 去离子水。再用 1 ml 50 mmol/L 碳酸氢铵,pH 8.0 洗 2 次。 7. 加入足够量的 50 mmol/L 碳酸氢铵以能盖住膜碎片(通常为 200~400 μl),加入 10 μg TPCK-胰蛋白酶(10 μl 1 mg/ml 储液),于 37 ℃ 孵育至少 2 h。 8. 再加入 10 μl 1 mg/ml TPCK-胰蛋白酶储液,于 37 ℃ 孵育 2 h。 9. 短暂的旋转振荡,全速短时离心收集管底的液体,上清液转移至新的微量离心管中。用 500 μl 去离子水洗膜碎片,短暂离心,将洗涤液加入前次的上清液中。 10. 在 SpeedVac 蒸发器中冻干,用契仑科夫计数法对洗脱下的 32P 标记肽进行定量测定。 11. 在过甲酸中孵育,使肽氧化(见基本方案步骤 15~17)。 12. 加入 500 μl 去离子水,冻干,然后在 TLC 平板上进行电泳(见基本方案步骤 21~31)。 展开 |
| 注意事项 | 洗脱液中应当含有 80%~90% 的放射活性。 |