用PCR识别不同的噬菌体抗体克隆
。不过,也可以先用PCR筛选方法估计所出现的不同克隆的数目。使用位于scFv基因旁侧的引物,直接从包含了噬菌粒的细菌克隆中扩增scFv。然后,用能多次切割V基因的限制性酶(如BstNI)消化PCR产物。尽管这对于来自非免疫文库的scFv很有效,但对于多样性受到更多限制的抗体文库效果较差。这是因为这些抗体文库中的多样性并非意味着限制性位点的增加或减少。一般而言,有不同限制性模式的scFv代表着各自独特的克隆。但具有相同模式的scFv也可能代表着不同的克隆(大约有10%的概率)。这起因于以下事实:BstNⅠ(和其他酶)一般切割V基因的框架区,因此结果更倾向于表示某个VH家族或成员,同某个VL家族或成员相配对。认真对指纹类型进行检查,也可以发现哪些克隆被部分消化。这会表现为大量常见条带伴随一些额外的条带,其强度有时并不与其他条带一致;或者条带长度累加也不与起始PCR产物的一致。在消化之前,将PCR产物的一份等量样本在胶上进行电泳是有用的。这将核实结合性抗体是否是全长。有时结合性单个结构域(VH)抗体也可从噬菌体文库中选择出来。
[器材和试剂]
● BstNⅠ限制性酶和缓冲液(New England Bi01abs)
● 引物
● PCR试剂和设备
● 矿物油(Sigma)
● Nusieve琼脂糖
● 10×TBE缓冲液[为准备10×TBE缓 冲液,在900ml水中溶解108g Tris和55g硼酸;加入40ml 0.5mol/L EDTA(pH 8.0),并用水加至1L)
[方法]
1.配制PCR“主混合液”,每克隆20ul PCR混合液, 包含:
● 水,15.5ul
● 10XRT缓冲液,2.0ul
● 5mmol/L dNTP, 1.0ul
● 5,引物,1.0ul
● 3,引物,1.0ul
● Taq聚合酶,0.2ul
如果PCR缓冲液中不含Mg2+,这应加至终浓度为1.5mmol/L。也可以使用与DNA聚合酶配套供应的PCR试剂。
2.取20fLl主混合液加到0.5m1管内,或加入96孔PCR微孔板孔内。
3.用l根牙签轻轻接触单个克隆并在PCR反应液中转动,注意不要转移太多材料。如在PCR反应液中有过量细菌,会抑制PCR反应。扔掉牙签;或如有需要,用它在1个单独的96孔培养孔板内培养基救援该克隆;或者在琼脂平板上接触表面。用1~2ul甘油储存料或主板培养液,也可以代替相应克隆。
4.反应液上铺上矿物油。
5.用PCR仪格内加热试管或孔板至94℃,10分钟。裂解细菌使其释放模板DNA。然后,以94℃1分钟、55~60℃1分钟(对于Fab片段文库的筛选则为2分钟)、72℃ 1分钟的条件孵育,共循环30次。
6.建议在PCR后取5ul PCR反应产物在2%琼脂糖胶上检测。这将显示有多少克隆包含全长的插入序列。
7.PCR后,在矿物油下面加入20ul主混合液,成分如下:
● 乙酰化BSA(10mg/ml), 0.2ul
● BstNⅠ缓冲液(10×),4.0ul
● 水,15.3ul
● BstNⅠ (10U/ul),0.54ul
8.60℃孵育样本2~3小时。
9.将2ul样本染液与8ul反应混合物(取自矿物油下面)混合并在4%Nusieve琼脂糖胶上电泳;此胶用含0.05ug/ml溴化乙锭的0.5倍TBE缓冲液配制。或者是用2.5%琼脂糖胶电泳(此胶的分辨率较低)。
10.以100V(10V/cm)跑胶并在UV transillu minator上比较各种不同的单独克隆的带型。
-
综述
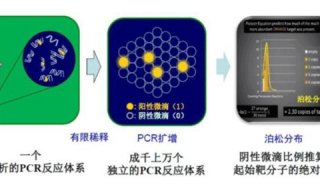
-
焦点事件
-
焦点事件











