紫外分光光度法测含量
【实验目的】
1.学习紫外分光光度法测定蛋白质含量的原理。
2.掌握紫外分光光度法测定蛋白质含量的实验技术。
3.掌握TU-1901紫外-可见分光光度计的使用方法并了解此仪器的主要构造。
【实验原理】
紫外-可见吸收光谱法又称紫外-可见分光光度法,它是研究分子吸收190~750nm波长范围内的吸收光谱,是以溶液中物质分子对光的选择性吸收为基础而建立起来的一类分析方法。
定性分析:利用紫外-可见吸收光谱法进行定性分析一般采用光谱比较法。即将未知纯化合物的吸收光谱特征,如吸收峰的数目、位置、相对强度以及吸收峰的形状与已知纯化合物的吸收光谱进行比较。
定量分析:紫外-可见吸收光谱法进行定量分析的依据是朗伯-比尔定律:A=lgI0/ I=ε bc,当入射光波长λ及光程b一定时,在一定浓度范围内,有色物质的吸光度A与该物质的浓度c成正比,即物质在一定波长处的吸光度与它的浓度成线形关系。因此,通过测定溶液对一定波长入射光的吸光度,就可求出溶液中物质浓度和含量。由于最大吸收波长λmax处的摩尔吸收系数最大,通常都是测量λmax的吸光度,以获得最大灵敏度。
紫外-可见分光光度计:紫外-可见吸收光谱法所采用的仪器称为分光光度计,它的主要部件有五个部分组成,即

由光源发出的复合光经过单色器分光后即可获得任一所需波长的平行单色光,该单色光通过样品池静样品溶液吸收后,通过光照到光电管或光电倍增管等检测器上产生光电流,产生的光电流由信号显示器直接读出吸光度A。可见光区采用钨灯光源、玻璃吸收池;紫外光区采用氘灯光源、石英吸收池。
本实验采用紫外分光光度法测定蛋白质含量。蛋白质中酪氨酸和色氨酸残基的苯环含有共轭双键,因此,蛋白质具有吸收紫外光的性质,其最大吸收峰位于280 nm附近(不同的蛋白质吸收波长略有差别)。在最大吸收波长处,吸光度与蛋白质溶液的浓度的关系服从朗伯-比耳定律。

优点:该测定法具有简单灵敏快速高选择性,且稳定性好,干扰易消除不消耗样品,低浓度的盐类不干扰测定等优点。
应用:定性分析-最大吸收波长
定量分析-朗伯-比尔定律(标准曲线法和标准加入法)
根据朗伯-比耳定律:A=εbc,只要绘出以吸光度A为纵坐标,浓度c为横坐标的标准曲线,测出试液的吸光度,就可以由标准曲线查得对应的浓度值,即未知样的含量。
【实验仪器与试剂】
仪器:TU-1901紫外-可见分光光度计,比色管,吸量管
试剂:标准蛋白质溶液:5.00 mg.mL-1溶液,0.9% NaCl溶液,待测蛋白质溶液(牛血清白蛋白)
【实验步骤】
(一)基本操作
1. 启动计算机,打开主机电源开关,启动工作站并初始化仪器。
2. 在工作界面上选择测量项目(光谱扫描,光度测量),本实验选择光度测量,设置测量条件(测量波长等)。
3. 将空白放入测量池中,点击START扫描空白,点击ZERO校零。
4. 标准曲线的制作。
(二)测量步骤
1.吸收曲线的绘制:
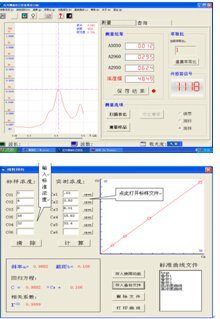
用吸量管吸取2mL5.00mg/mL标准蛋白质溶液于10mL比色管中,用0.9% NaCl 溶液稀释至刻度,摇匀。用1cm石英比色皿,以0.9% NaCl 溶液为参比,在190 nm~400nm区间,测量吸光度。
2. 标准曲线的制作:
用吸量管分别吸取1.0 、1.5、 2.0 、2.5 、3.0 mL 5.00 mg.mL-1标准蛋白质溶液于5只10 mL 比色管中,用0.9% NaCl溶液稀释至刻度,摇匀。用1 cm石英比色皿,以0.9%NaCl溶液为参比,在280 nm处分别测定各标准溶液的吸光度A280,记录所得读数。
3. 样品测定:
取待测蛋白质溶液3 mL,按上述方法测定280 nm处的吸光度。平行测定三份。
【数据处理】
1. 以波长为横坐标,吸光度为纵坐标,绘制吸收曲线,找出最大吸收波长。
2. 以标准蛋白质溶液浓度为横坐标,吸光度为纵坐标绘制标准曲线。