生物仿制药高峰论坛在沪隆重开幕
2011年11月25日,由生物谷联合中国生物工程杂志社共同主办的“Biosimilar & FOB China 2011---生物仿制药高峰论坛”在上海隆重召开。随着大量生物制药ZL即将到期,以biobetter为理念的生物仿制药产业成为未来几年制药领域新的机遇。本论坛围绕“生物仿制药发展策略与技术要点”话题,从市场与合作、技术与应用、投融资等环节进行深入讨论与分析,全面阐释了中国仿制药产业。来自生物医药界相关专家、企业领导、政府监管部门领导、国际投资机构高管、知识产权专家、媒体近200人参加了此次盛会。
大会现场
中国工程院 杨胜利院士
首先中国工程院院士兼中国工程院医药卫生学部主任兼《中国生物工程杂志》编委会主任杨胜利老师致大会开幕词。
杨老师在致辞中表示生物仿制药不仅被发达国家而且也被发展中国家所关注。我国在生物仿制药领域具有深厚的背景,如何更好的加快我国生物仿制药的研发速度,从而同发达国家竞争,是我们正在面临的挑战。目前我国针对生物仿制药的审批系统还是空白,都是按照新药进行审批,实际上在欧洲、美国、以及其他的发展中国家,对生物仿制药建立了相关法规,并且审批程序相比中国要简单的多。因此针对生物仿制药的监管体系的完善是亟待解决的问题。本次论坛是监管界、科研界、产业界盛大集会,在本次论坛上大家将围绕生物仿制药的相关话题展开积极探讨交流,相互学习借鉴,为促进我国生物医药的发展做出贡献。
接下来进入大会报告环节,来自中国转化医学与生物技术创新联盟、第四军医大学细胞工程研究中心的蒋建利老师为大家演讲了题为《中国生物仿制药的发展与未来》报告。
中国转化医学与生物技术创新联盟、第四军医大学细胞工程研究中心蒋建利老师
世界医药产业和市场具有广阔的前景,国际货币组织在2010年发表数字显示,药物在2009年的市场总额为8150亿美元,到2010年上升比例7.9%达8800亿美元。其中非ZL药(仿制药)在2010年的市场总额达1200亿美元,相比2009年上升了33.3%。这一数字预计在今后的几年将持续上涨。国家食品药品监督管理局在2010年发表数字表明,中国医药市场总额已达到1200亿元,其中生化生物制品占据1062.45亿元。2010年全球药物销售前20名中,有8种是生物药物,可见生物药物的重要性。
从1993年到2010年全球生物药物市场都呈现出不同程度的增长。到2010年,抗体药物占据生物药物的1/3。目前美国FDA和欧盟EMEA批准上市抗体治疗药物共计36个,其中人源化及嵌合抗体占19个;我国也也批准了16个抗体药物上市,其中人源化及嵌合抗体占11个,但是16种抗体中国产抗体药物只占据了6个,因此在抗体药物研发上上,我国仍需加大步伐。
在疫苗方面,美国FDA目前已批准了80种,其中基因工程重组疫苗有7种,但正用于临床研究的有491种;我们国家已批准的有334种,基因工程重组疫苗占据23种。
在生物治疗方面,分为细胞治疗、基因治疗和核酸药物。美国FDA批准了用于治疗前列腺癌的Provenge(Sipuloucel-T)和用于美容的LaViv(Axficel-T)两个细胞治疗药物;中国SFDA只批准了一个用于肿瘤长效镇痛的牛肾上腺嗜铬细胞镇痛微囊;在基因治疗药物方面,SFDA批准了用于头颈部镇痛的重组腺病毒P53抗癌注射液及用于晚期鼻咽癌的重组5型腺病毒注射液,FDA在这方面空白;针对核酸药物,SFDA没有批准上市这类药物,FDA批准了50余种组分,组合数百种药物。
接下来,蒋老师分别针对抗体、疫苗、细胞治疗三类药物一一举例说明,最后又分别介绍了抗体药物与抗体工程的关键技术、疫苗工程关键技术、细胞治疗关键技术等内容。
上海市生物医药科技产业促进中心 傅大煦副主任
来自上海市生物医药科技产业促进中心傅大煦副主任同大家探讨了上海生物医药发展规划及开展生物仿制药发展政策。
傅主任从健康上海十二五规划以及生物仿制药发展策略两方面展开演讲,并为生物仿制药的发展提出几点建议包括,抗体药物中新靶点的选择、抗体的人源化、小型化、高效化、临床联合治疗是未来发展的五大趋势;疫苗研究中,重组疫苗大规模培养及纯化技术是以后发展的重点;重组蛋白药物研究中需客观选择重组药物种类作为研发起点,以基因工程或其他修饰方法改造现有产品为突破口,力求在生产方式和效率上取得突破。
昭衍新药研究中心首席技术官 龚兆龙先生
原FDA资深药物审评专家/昭衍新药研究中心首席技术官龚兆龙先生的报告题为《美国及欧盟审批生物仿制药制度对我国的启示》。
欧盟是全球制定生物仿制药法规起步最早也是相对最健全的地方。2005年出台《生物仿制药指导原则》;2006年-2010年先后出台了针对胰岛素、促红细胞生成素、人生长激素、重组人干扰素β、单克隆抗体等9种非临床和临床研究指导原则。欧盟也是生物仿制药的发展速度最快的地区,目前已有16个产品获批准。日本,韩国等亚洲国家已经参照欧盟模板制定出相应的生物仿审批标准。美国相对保守,但迫于公众压力2007年国会通过了《生物制品价格竞争和创新法案》,奥巴马总统2010年签署了医疗改革法案,规定生物仿制药可以自由替换原研药。美国FDA目前正在制定生物仿制药审批指导原则,类似欧盟,但会保留更多灵活性,预计今年年底能够颁布实施。
中国尚没有专门针对生物仿制药的申请政策,2007年版《药品注册管理办法》中规定所有生物制品需按照新药来审批。欧盟和美国,以及日韩等国的经验非常值得我们借鉴,针对已经批准上市的大量生物仿制药要做到进一步规范化。
法码康公司黄晓总裁
来自法码康公司的黄晓总裁作了题为《生物仿制注册及临床研发之挑战》的报告。
仿制药分为化学仿制药和生物仿制药。化药仿制在技术上没有任何壁垒,导致ZL一旦到期,马上形成大量药企的无序竞争,这自然使得企业只能获得微薄的市场平均利润。而生物仿制药的门槛高,存在相当的难度、竞争少、研发生命周期长,在相当长的时间内会是有序竞争,利润上存在优势。这也是生物仿制药被制药企业热捧的原因。
目前生物仿制药在生产、临床研究及注册方面同样面临很大的挑战。
在生产过程中由于复杂的分子结构面临同质化终端产品批次少、少批量产品具备稳定性、生物仿制药与参考产品的鉴定以及质量控制等技术难题。
在临床研发过程中的挑战表现在免疫源性研究、安全药物警戒、药代动力学/药效动力学研究、以及生物相似性研究等方面。
在药品注册过程中,SFDA法则苛刻,没有相关的法规,且逐案审批,影响效率。
部分与会代表合影
第一天会议结束后,广州市国际投资促进中心赞助晚宴,会务组对与会者表示了热烈欢迎。大家在轻松、愉快的氛围中享用美食,探讨交流。
晚宴现场
更多精彩报告,请继续关注分析测试百科网后续报道......
-
项目成果

-
市场商机

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
项目成果

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
会议会展

-
企业风采

-
产品技术

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
财报

-
科技前沿

-
焦点事件

-
精英视角

-
企业风采

-
焦点事件

-
产品技术

-
焦点事件
-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件
-
焦点事件

-
项目成果
-
科技前沿

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件
-
焦点事件
-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件

-
焦点事件

-
投融资
-
企业风采
-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
企业风采

-
产品技术

-
精英视角

-
会议会展

-
焦点事件

-
焦点事件

-
企业风采
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
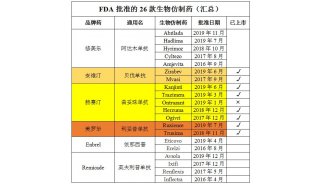
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
综述
-
企业风采

-
焦点事件

-
科技前沿
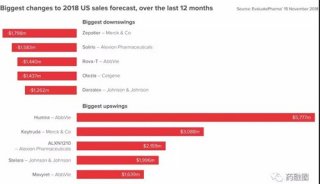
-
焦点事件

-
焦点事件

-
科技前沿