重组蛋白的表达与纯化
实验概要
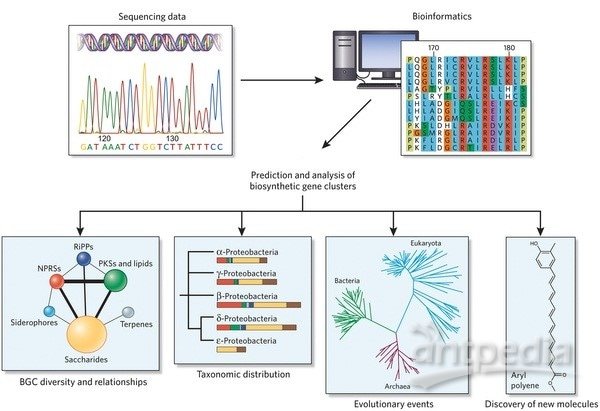
本实验将重组大肠杆菌经过诱导培养后,获得了表达的重组蛋白,分别用Ni-NTA柱亲和层析、High Q与DEAE阴离子交换层析、Glutathione柱亲和层析进行了层析纯化,并进行了浓缩。
实验步骤
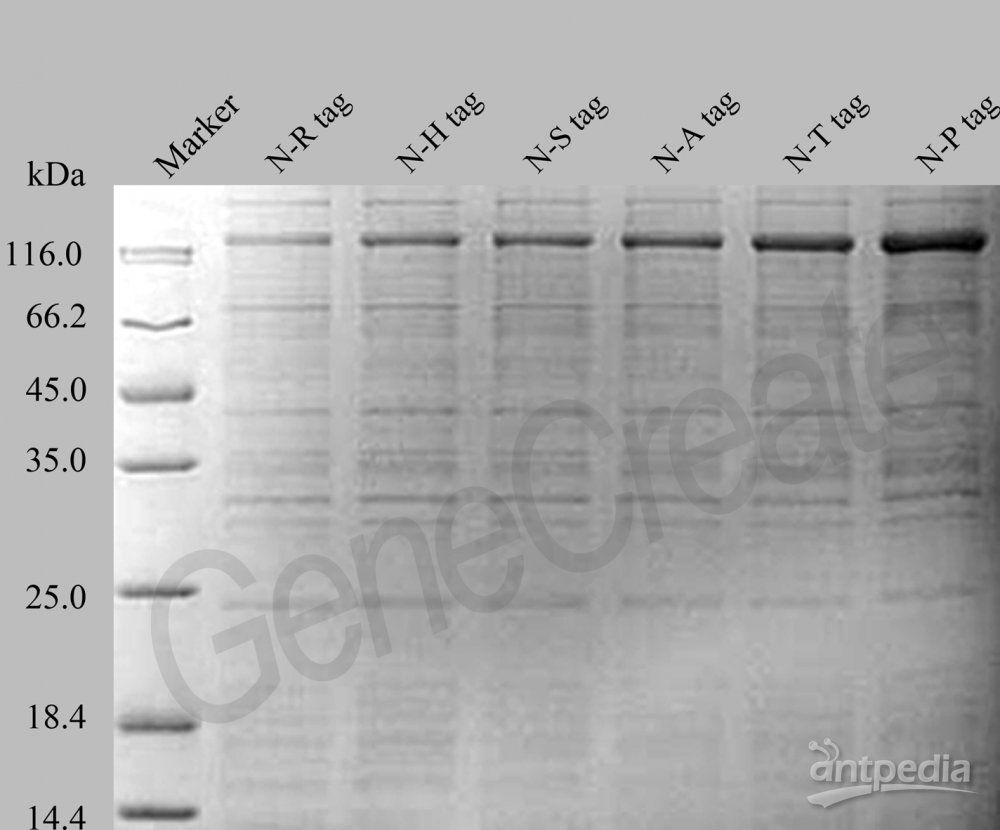
1. 将测序正确的质粒转化Rosetta(DE3)菌,过夜培养后,挑取单菌落,于小试管内进行IPTG诱导实验,即37℃培养至OD600为0.6后,加入1mM IPTG,37℃继续培养3h。将全菌液收集后破碎,SDS-PAGE电泳检测,选取表达量高的单菌落进行大量表达。
2. 将含有flotillin-2质粒的Rosetta(DE3)菌,接种至含氨苄的LB培养基中,37℃振荡培养过夜,以0.2%接种于自动诱导培养基中,37℃培养至OD为0.6。降温至20℃,培养过夜。
3. 离心收集菌体,用300mL离心管,6000g离心10min。将菌体悬浮于相应的裂解缓冲液中,洗涤一次,用300mL离心管6000g离心10min,再次将菌体悬浮于预冷的相应的裂解缓冲液中,体积为培养基体积的1/5。
4. 超声波破碎细菌,控制功率为200W。工作条件为超声4s,暂停lose 90次,以冰浴降温。若还有块状物或者沉淀,可再重复一次。在4℃以20000g高速离心30min收集上清,保存于-20℃或立即进行层析纯化。
1) Ni-NTA柱亲和层析
配制如下溶液:
His6裂解缓冲液(用于裂解含His6 Tag的重组蛋白)50mM Tris-HCl缓冲液,pH8.0;I0mM imidazole;150mM NaCI;0.1% TritonX-100;10%甘油;使用前加入PMSF,使其终浓度为200ug/mL;
His6洗涤缓冲液(用于洗涤含His6 Tag的重组蛋白)
50mM Tris-HCl缓冲液,pH8.0;20mM imidazole;150mM NaCI;0.1% TritonX-100;10%甘油;使用前加入PMSF,使其终浓度为200ug/mL;
His6洗脱缓冲液(用于洗脱含His6 Tag的重组蛋白)
50mM Tris-HCl缓冲液,pH8.0;200mM imidazole;150mM NaCI;0.1% TritonX-100;10%甘油;使用前加入PMSF,使其终浓度为200ug/mL;
将表达有目的蛋白的Rosetta菌用His6裂解缓冲液溶解,超声破菌,离心,取上清以1 mL/min泵送至His6裂解缓冲液预先平衡的Ni-NTA Superflow层析柱(l0mL,15X1cm),His6裂解缓冲液洗涤至基线水平后,再用3倍柱体积(30mL )的His6洗涤缓冲液洗涤,最后用1倍柱体积(10mL)的Hiss洗脱缓冲液洗脱。
2) High Q与DEAE阴离子交换层析
配制如下溶液:
A溶液l0mM Tris-HCl缓冲液,pH 7.5;
B溶液1M NaCI溶解于l0mM Tris-HCl缓冲液,pH 7.5;
用溶液A平衡20mL体积(l0X 1.6cm)的DEAE-Sepharose CL-6B层析柱,流速为1 mL/min,至OD280。基线水平后,将含目的蛋白上清液(低盐)泵送过柱,流速为1 mL/min,泵送完毕后,再次用溶液A洗涤层析柱至基线水平,开始用溶液A和溶液B形成线性梯度,流速为1mL/min,B溶液从0%至100%的梯度总体积为100mL。分步收集器每2mL收集一管洗脱液。
3) Glutathione柱亲和层析
配制如下溶液:
GST裂解缓冲液(用于裂解和洗涤含GST Tag的重组蛋白)
50mM Tris-HCl缓冲液,pH8.0;5mM EDTA;150mM NaCI;0.1% Triton X-100;湿热灭菌;使用前加入PMSF,使其终浓度为200ug/mL。
GST洗脱缓冲液(用于洗脱含GST Tag的重组蛋白)
50mM L-Glutathione (reduced form);50mM Tris-HCl缓冲液,pH8.0(将0.0896gGlutathione溶解于10mL缓冲液后,需要用NaOH调节pH值);5mM EDTA;150mM NaCI;0.1% Triton X-100;使用前加入PMSF,使其终浓度为200ug/mL。
将表达有目的蛋白的Rosetta菌用GST裂解缓冲液溶解,超声破菌,离心取上清以2mL/min泵送至GST裂解缓冲液预先平衡的Glutathione Sepharose 4B层析柱(5mL,15X0.7cm),GST裂解缓冲液洗涤至基线水平,最后用1倍柱体积(10mL)的GST洗脱缓冲液洗脱。
5. 纯化蛋白质超滤浓缩
将得到的高纯度蛋白质洗脱液进行排阻离心超滤,通过排阻孔径合适的超滤管离心将蛋白滞留在超滤管膜上,让缓冲液通过膜离,自去除,以达到浓缩的效果。方法为:挑取SDS-PAGE电泳检测纯度和浓度相对较高的蛋白质洗脱液,加入超滤管中5000rpm,4℃条件下离心20min,去除收集管内的滤出液后在向管内加入新的蛋白质洗脱液并吹打混匀管内蛋白质以避免蛋白质局部浓度过高而沉淀,每次吸取超滤管内蛋白质进行Bradford法浓度测定(以l0mg/m1BSA作为参照的标准蛋白),超滤至蛋白管内蛋白质总量约10mg左右。此后加入5-10ml的5mMTris-HCl ( pH8.5 )缓冲液进行超滤以稀释蛋白质溶液,去除可能影响结晶的多余的盐分及其它离子,超滤过程中离心时间以每次离心至超滤管内液面低于1ml刻度线为准,然后重新加入新的5mM Tris-HCl缓冲液,此过程重复5-6次。最后超滤至20mg/ml左右(大约至超滤管内剩下500ul溶液),然后将溶液混匀后分装(50uI一管)后用液氮速冻于-70℃保存待结晶。
-
仪器推荐

-
仪器推荐
-
仪器推荐
 询底价 Tel:400-6699-117 转 5085
询底价 Tel:400-6699-117 转 5085 -
仪器推荐
-
仪器推荐
-
企业风采

-
焦点事件