Nature:组蛋白标记H3K36me2招募DNMT3A并影响基因间DNA甲基化
催化DNA中CpG甲基化的酶,包括DNA甲基转移酶1(DNMT1)、DNA甲基转移酶3A(DNMT3A)和DNA甲基转移酶3B(DNMT3B)。这些DNA甲基转移酶对于哺乳动物组织发育和体内平衡是必不可少的。它们还与人类发育障碍和癌症有关,这就支持DNA甲基化在细胞命运的指定和维持中起着关键作用。
之前的研究已表明组蛋白的翻译后修饰参与了确定启动子和活跃转录基因体的DNA甲基转移酶定位和DNA甲基化的模式。然而,控制基因间DNA甲基化的建立和维持的机制仍然知之甚少。
塔顿布朗拉赫曼综合征(Tatton–Brown–Rahman syndrome, TBRS)是一种儿童过度生长障碍,是由生殖系DNMT3A突变导致的。儿童期巨脑畸形综合征(Sotos syndrome)是由NSD1的单倍剂量不足引起的,其中NSD1是组蛋白甲基转移酶,催化组蛋白H3在K36位点发生二甲基化(H3K36me2)。TBRS与儿童期巨脑畸形综合征具有相同的临床特征。这表明这两种疾病存在机制上的关联性。
图片来自Nature, 2019, doi:10.1038/s41586-019-1534-3。
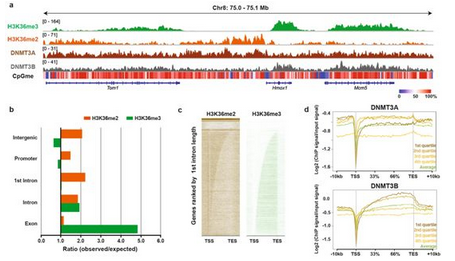
在一项新的研究中,来自美国哥伦比亚大学欧文医学中心、洛克菲勒大学和加拿大麦吉尔大学等研究机构的研究人员报道NSD1介导的H3K36me2是在基因间区域招募DNMT3A和维持DNA甲基化所必需的。相关研究结果发表在Nature期刊上,论文标题为“The histone mark H3K36me2 recruits DNMT3A and shapes the intergenic DNA methylation landscape”。
全基因组分析表明DNMT3A的结合和活性与常染色质的非编码区域的H3K36me2共定位。在小鼠细胞中剔除基因Nsd1及其旁系同源物Nsd2导致DNMT3A重新分布到H3K36me3修饰的基因体上并且减少基因间DNA的甲基化。
来自患有儿童期巨脑畸形综合征和NSD1突变体肿瘤的患者的血液样品也表现出基因间DNA的低甲基化。
DNMT3A的PWWP结构域在体外表现出对H3K36me2和H3K36me3的双重识别,并且对H3K36me2具有更高的结合亲和力,这种更高的结合亲和力可通过源自TBRS的DNMT3A错义突变加以破坏。
综上所述,这项新的研究揭示了一种跨染色质调节途径,这种调节突进将异常的基因间CpG甲基化与人类肿瘤生长和过度发育相关联在一起。
参考资料:
Daniel N. Weinberg et al. The histone mark H3K36me2 recruits DNMT3A and shapes the intergenic DNA methylation landscape. Nature, 2019, doi:10.1038/s41586-019-1534-3.





















