快速了解还原糖的测定
实验原理
斐林试剂法
还原糖与斐林试剂发生作用,可以生成砖红色沉淀。
所需试剂
斐林试剂(主要由质量浓度为0.1g/mL的NaOH溶液和质量浓度为0.05g/mL的CuSO4溶液配制而成)
注意:现配现用
实验材料准备
植物组织是常用的实验材料,但必须加以选择。本实验最理想的实验材料是含糖量较高的生物组织(或器官),而且组织的颜色较浅,或近于白色的,如苹果和梨的果实。经试验比较,颜色反应的明显程度依次为苹果、梨、白色甘蓝叶、白萝卜。

操作方法
①向试管内注入2mL待测组织药液
②向试管内注入1mL斐林试剂(甲液和乙液等量混合均匀后再注入)
③将试管放入盛有50~65℃温水的大烧杯中加热约2min
④观察试管中出现的颜色变化
其他说明
斐林试剂和班氏试剂等都是检验还原性糖的试剂,二者的使用方法及原理、成分有区别。下面就从这几种试剂的使用原理、成分及使用方法等方面做一简单总结。
1. 斐林试剂和双缩脲试剂
斐林试剂和双缩脲试剂都由NaOH溶液和CuSO4溶液组成,但二者有如下三点不同:
(1)溶液浓度不同
斐林试剂中溶液为斐林试剂甲(NaOH溶液)其浓度为0.1g/ml,斐林试剂乙(CuSO4溶液)其浓度为0.05g/ml;双缩脲试剂:双缩脲试剂A(NaOH溶液)的浓度为0.1g/ml,双缩脲试剂B(CuSO4溶液)的浓度为0.01g/ml。
(2)使用原理不同
斐林试剂是新配制的溶液,它在加热条件下与醛基反应,被还原成砖红色的沉淀,可用于鉴定可溶性还原糖的存在。用斐林试剂鉴定可溶性还原糖时,溶液的颜色变化过程为:浅蓝色→棕色→砖红色(沉淀)。
鉴定生物组织中是否含有蛋白质时,常用双缩脲法,使用的是双缩脲试剂,发生的是双缩脲反应。双缩脲反应实质是在碱性环境下的与双缩脲试剂发生的紫色反应。而蛋白质分子中含有很多与双缩脲()结构相似的肽键,所以蛋白质都能与双缩脲试剂发生颜色反应,可以用双缩脲试剂鉴定蛋白质的存在 [3] 。
(3)两种试剂的保存方式不同。斐林试剂甲和斐林试剂乙可强烈产生,很容易沉淀析出,因此斐林试剂一般为现用现配;而班氏试剂的配方中,柠檬酸钠为一对缓冲物质,产生的数量有限,与溶液混合后产生的浓度相对较低,不易析出,因此该试剂可长期保存 [3] 。
当然,无论用班氏试剂还是斐林试剂,归根结底都是与醛基在沸水浴加热条件下反应而生成砖红色的沉淀,两者反应现象一样,这就是二者的相同之处。
(4)备注:
如果溶液中还原糖含量较低,产生的氧化亚铜便会较少,试验后只会有绿色、混浊的黄色或橙色等。
在酸性环境中,Cu2 会变得较为稳定,不容易发生反应,所以不能进行试验。
醇和醛在这测试亦会产生砖红色沉淀物,因为两者都具有在这试验中产生作用的官能团。
-
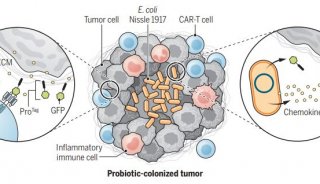
项目成果

-
投融资

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
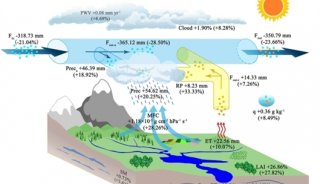
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
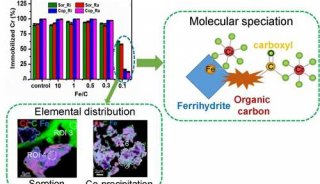
-
项目成果
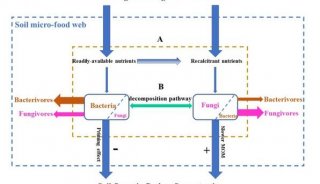
-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件

-
精英视角

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
精英视角

-
科技前沿

-
精英视角

-
焦点事件

-
焦点事件

-
焦点事件

-
精英视角
-
精英视角