哈佛大学实验室发现CRISPR/Cas9存在严重脱靶效应
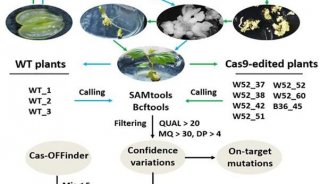
哈佛大学David R Liu实验室利用体外筛选和高通量测序检测CRISPR/Cas9的脱靶,针对CLTA基因的四个不同靶位点共设计了八条不同序列的gRNA,即每个靶位点有两条gRNA,结果发现,四个靶位点均存在脱靶现象,脱靶效率最高可达 84%,同时CRISPR/Cas9的特异性仅与gRNA配对的靠近PAM处7-12bp碱基相关,CRISPR/Cas9存在严重的脱靶效应。该研究成果发表在《Nature Biotechnology》杂志上。
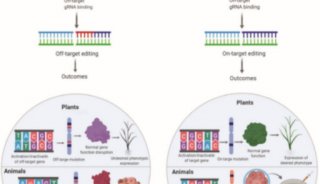
CRISPR/Cas9是一种来源于细菌获得性免疫的由RNA指导Cas9蛋白对靶向基因进行修饰的技术。有文献报道,CRISPR/Cas9的切割是通过向导RNA(gRNA)与基因组位置之间20bp碱基的配对,且配对碱基的5′端需要有PAM结构(NGG),再引导Cas9作用实现的,但是CRISPR/Cas9与靶位点识别的特异性主要依赖于gRNA与靠近PAM处10-12bp碱基的配对,而其余远离PAM处8-10bp碱基的错配对靶位点的识别影响不明显,这项研究直接说明了CRISPR/Cas9存在严重的脱靶性,即该技术可以发生非特异性切割,引起基因组非靶向位点的突变,这样会造成研究结果的不确定性以及研究工作的大量增加,这一问题严重地限制了Cas9的应用。
哈佛大学David R Liu实验室为了研究CRISPR/Cas9技术的脱靶效应的程度,针对人CLTA基因的四个不同靶位点共设计了八条不同序列的gRNA,即每个靶位点有两条gRNA,并通过体外筛选和高通量测序检测脱靶效应发现,四个靶位点均存在脱靶现象,脱靶效率最高可达84%。同时与以前的研究结果对比,本研究得出 CRISPR/Cas9的特异性仅与gRNA配对的靠近PAM处7-12bp碱基相关。因此,特异性非常低。实验结果还表明,在体外和细胞中gRNA的活性和特异性是需要权衡的,长度短的gRNA比长度长的gRNA特异性更高,而活性却是相反的。研究人员还发现,gRNA:Cas9混合物浓度的提高会提高 Cas9的切割活性,但是进一步降低了gRNA:Cas9混合物打靶的准确性,包括会在PAM附近引起突变,从而增强脱靶效应。
背景介绍:
目前最常用的基因修饰技术有ZFN、TALEN和CRISPR/Cas9。ZFN由一系列锌指蛋白和Fok I非特异性核酸内切酶构成,两个ZFN分别结合到靶序列后,激活Fok I使DNA特定位点产生双链断裂,但是ZFN技术存在不能识别任意目标基因序列、识别序列经常受上下游序列影响以及费用昂贵等问题。TALEN由TALE 蛋白和FokI 核酸内切酶组成,利用TALE的序列模块,可组装成特异结合任意DNA序列的模块化组合蛋白,从而达到识别内源性基因的目的。
FastTALE技术的出现使得TALEN质粒的构建可以很容易地在1天内完成,从而进一步推动了TALEN技术的应用。CRISPR/Cas9是由CRISPR相关基因和Cas9 基因组成,Cas9会在gRNA的指引下,在完整基因组上的特定位点完成切割反应,同时CRISPR/Cas9的切割也依赖于gRNA和基因组特定位点配对区5′端的PAM结构,这也进一步限制了gRNA的设计。
更为重要的是,文献中报道CRISPR/Cas9存在严重的脱靶效应,此特性的存在一方面对细胞水平的打靶在基因功能的研究会造成混乱的局面,很难分析某功能的缺失是由哪个基因的敲除引起的,另一方面在动物模型应用中,CRISPR/Cas9的脱靶性尽管可以通过多代交配的方式稀释脱靶,但是这个过程会增加工作量和科研经费的开支,因此限制了CRISPR/Cas9的应用。