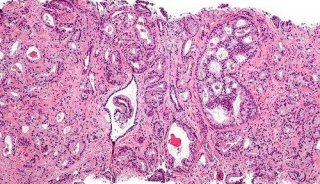
复旦大学长江学者Cell子刊发表癌症新文章
来自复旦大学、美国梅奥临床医学院(Mayo Clinic College of Medicine)等处的研究人员证实,野生型的SPOP E3泛素连接酶负责破坏全长的雄激素受体(Androgen Receptor,AR),由此揭示了SPOP突变在前列腺癌发病和进展中的重要的作用及其分子机制。这些研究发现在线发表在2月6日的《Cell Reports》杂志上。
复旦大学遗传学教授、教育部“长江奖励计划”特聘教授余龙(Long Yu)及梅奥临床医学院的黄浩杰(Haojie Huang)博士是这篇论文的共同通讯作者。余龙教授的主要研究方向为肝癌发生的分子遗传学机制研究和抗肝癌药物小分子化合物筛选、以及重大疾病相关基因的系统生物学及药物开发研究。
前列腺癌(Prostate Cancer, PCa)是男性泌尿生殖系统常见的恶性肿瘤之一,全球每年有超过91.3万新增病例,导致26.1万多人死亡。尽管在大约90%的前列腺癌患者中雄激素剥夺治疗(androgen deprivation therapy)最初起效,但这一疾病不可避免地将以致命性、去势抵抗性前列腺癌(castration-resistant prostate cancer ,CRPC)形式复发。
AR是对正常前列腺细胞生长和存活至关重要的一种转录因子。在前列腺癌的发生与发展中AR也起着极其重要的作用。人们认为,包括AR扩增或过表达、功能获得性突变等大量机制导致的AR持续激活与去势抵抗性前列腺癌的形成存在因果联系。
泛素是一种存在于真核生物中且在进化中高度保守的小分子蛋白,含76个氨基酸残基。在蛋白酶体中进行的底物蛋白泛素化过程依赖一个复杂的系统,它包括泛素活化酶(E1)、泛素-联连酶(E2)和底物识别蛋白(E3酶)。依赖泛素的蛋白质降解途径可以选择性地降解细胞内的蛋白质,是一条重要的非溶酶体蛋白降解途径。
越来越多的证据表明,泛素-蛋白酶体信号通路调控失常与癌症发病相关。通过对前列腺癌进行系统的全基因组或外显子组测序,科学家们发现了SPOP的频繁体细胞突变。有趣的是,迄今为止描述的所有SPOP突变影响的都是称之为底物结合MATH结构域的进化保守残基。包含突变SPOP的前列腺癌几乎完全没有PTEN和TP53肿瘤抑制基因突变,表明了一种新的前列腺癌分子亚型。除了突变,在前列腺癌中SPOP蛋白的表达也常常下调。然而,对于SPOP促成前列腺癌发病和进展的机制却仍然并不清楚。
在这篇文章中研究人员证实,SPOP可以识别AR铰链结构域中一个富含Ser/Thr的降解决定子(Ser/Thr),诱导全长AR降解,抑制AR 介导的基因转录和前列腺癌细胞生长。丧失铰链结构域的AR剪接变异体可以逃避SPOP介导的蛋白质降解。前列腺癌相关的SPOP突变体不能结合并促进AR 破坏。此外,研究人员发现雄激素可以对抗SPOP介导的AR降解,而抗雄激素则可促进这一过程。
新研究确定了AR是SPOP的一个底物,阐明了SPOP突变对前列腺癌的影响,表明这一信号通路在前列腺癌抗雄激素治疗抵抗中起着重要的作用。
-
产品技术

-
焦点事件

-
焦点事件

-
科技前沿
-
项目成果

-
企业风采

-
科技前沿
-
综述
-
焦点事件

-
焦点事件

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果

-
产品技术

-
科技前沿
-
科技前沿