CFDA答一致性评价中最受关注问题:机构数量不够怎么破
5月17日,在2016中国国际药物信息大会暨第八届DIA中国年会上,CFDA药化注册司副司长李茂忠就当前仿制药一致性评价最受关注问题之一“愿意承接一致性评价的临床机构数量有限,首批开展品种在2018年底完成困难”作答:“CFDA此前公示的首批开展一致性评价工作的截止日期不会改变,我们将在实际工作中具体了解机构对BE试验的承接情况;同时,CFDA将与卫计委联动,积极推动问题解决”。
临床资源到底是否足够?
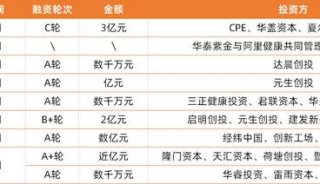
Insight数据显示,首批需要在2018年底前完成一致性评价共涉及292个基本药物目录品种,共涉及19715个批准文号,其中可以确定的有效批文为70.34%;涉及企业数量为2028家,其中7家企业批文数量超过100个,47家企业所持批文数量为50-100个,529家企业批文数量在10-50之间;上海医药、华润双鹤、白云山、哈药、复星医药五家上市公司分别以505、211、200、144、132个批文数量位列所持批准文号数量排行榜前五位。
目前,CFDA仍有数项关于此次仿制药一致性评价工作的具体要求和指导原则处于征求意见阶段,随着正式文件的陆续发布,留给企业实际操作的时间也越来越短。而国务院办公厅在2016年3月5日发布的《关于开展仿制药质量和疗效一致性评价的意见》中强调,逾期未完成的,不予再注册。
截止2015年底,全国共有433家GCP证书未到期,而根据CDE临床试验登记平台和中国临床试验注册中心ChiCTR数据,只有122家开展过BE/I期项目,而在2015年9月CFDA发布的核查清单中,82家机构涉及“722自查核查风暴”。此前2016年1月,业界曾有一项调研显示,400余家临床试验机构中仅有53家机构表示愿意承接BE/I期项目。做一个简单的计算,数据预测基于不完全的业界数据和经验,如有异议敬请留言:暂不考虑BE豁免。
假如,拥有24张床位的临床试验机构平均开展一项临床试验的平均时间为1个月;
假如,CFDA关于此次仿制药一致性评价的所有工作要求能够在今年6月前全部发布,那么距离2018年底,还有30个月的时间;
假如,上述愿意承接BE/I期53家机构平均有24张BE/I期床位;
推导一下,只有30*53=1590个品种来得及通过这一轮仿制药一致性评价,每个品种平均有5.4个批文可以获得BE资源。
这意味着,在规定时限内,逾13800个批准文号中的近90%都将没有临床资源可用。对企业来说,无论产品此前销售额如何,谁能抢占到BE资源,谁将成为主宰2019年以后市场的、最幸运的5.4个品种之一。
这或许也是,近期频繁被爆出的、高达300万-500万元的BE临床试验费用的缘由。
然而对药企来说,这不仅增加以“价廉”为特征的基本药物现有成本,未来还可能造成更多的基本药物短缺问题;此外,CFDA在临床试验质量自查核查以来一直强调的“由企业承担主体责任”理念也将面临挑战:面对一个有合法伤害权的权利怪兽,企业如何履行监察的职能?
“我们要努力营造一个‘良药走遍天下,劣药寸步难行’的社会环境”。这是CFDA局长毕井泉在上任伊始在北京大学演讲时传递的信念。这意味着,给良药以机会,而不是让良药在自证之前先掉层皮。如此局面,如何破?需要注明的是,上述论证是在仅有53家机构愿意承接BE试验的前提下才会产生的困境。如果曾经接开展过BE/I期临床试验的122家机构都参与进来,临床资源将相对充裕;如果强制全部拥有GCP证书的机构都承接BE试验项目,前述过万的有效批文都将不存在BE试验资源紧缺的情况。
然而,很多临床试验机构不愿承担BE/I期临床试验的情况客观存在,其理由包括但不限于此类试验并不能够帮助所在临床研究机构建立声誉、帮助相关研究者建立学术地位。因此,破解临床试验资源优先困境不仅需要CFDA尽快组织情况摸底、重新审视GCP认证,也需要卫计委协调实际资源。
据记者了解,自2015年12月国务院同意建立药品医疗器械审评审批制度改革部际联席会议制度,由CFDA牵头、卫计委参与的部际联席会议已成功召开一次。而截止目前,关于临床试验资源配置的议题尚未进入部际联席会议的讨论范围。
-
科技前沿
-
焦点事件

-
项目成果
-
焦点事件