何伟奇等揭示治疗炎症性肠病的新途径
炎症性肠病(inflammatory bowel disease,IBD)是一类慢性、非特异性肠道炎症疾病。IBD患者均不同程度的伴有肠黏膜屏障功能损伤。肠上皮屏障通透性主要由上皮细胞之间的紧密连接(tight junction)来进行调控。紧密连接附近存在一个称为紧密连接周围肌动球蛋白环(perijunctional actomyosinring,PAMR)的结构。肌球蛋白轻链激酶(myosin lightchain kinase,MLCK)能够磷酸化肌球蛋白轻链(MLC),引起PAMR收缩,牵引与之相连接的紧密连接蛋白,从而增大相邻细胞间隙,增加肠上皮细胞间通透性。
肿瘤坏死因子(TNF)是引发肠黏膜屏障功能受损的关键炎症因子。TNF通过增加MLCK表达、激活其激酶活性的途径增加肠上皮紧密连接通透性、促进炎症性肠病发生【1,2】。目前治疗IBD广泛采用抗TNF抗体。尽管取得了一定的效果,但长期使用该类药物会导致一系列不良反应,包括引发严重感染和系统性红斑狼疮等免疫疾病【3】。因此,开发非免疫抑制类型的新型药物,可能是预防和治疗炎症性肠病的新途径。上皮MLCK敲除的小鼠能够改善肠黏膜屏障功能,抵抗炎症性肠病的发生【4】。然而MLCK还具有维持肠平滑肌收缩和肠道蠕动的重要功能,直接抑制MLCK激酶活性将不可避免地导致麻痹性肠梗阻【5】。因此,MLCK激酶抑制剂并不能用于治疗炎症性肠病。
2019年4月2日,芝加哥大学/哈佛大学医学院Jerrold R. Turner教授研究组与苏州大学剑桥-苏大基因组资源中心何伟奇教授研究组和合作在Nature Medicine发表题为Intracellular MLCK1 diversion reverses barrier loss to restore mucosal homeostasis的研究论文。

该研究发现上皮MLCK的两个剪切异构体MLCK1和MLCK2在肠上皮细胞中呈现不同的分布。和MLCK2相比,MLCK1具备一个特有的IgCAM3结构域,主要分布在PAMR和刷状缘附近的细胞质(图1)。TNF可以诱导MLCK1从胞质向PAMR转运,并提高MLC磷酸化水平。MLCK2在细胞中广泛分布且其定位不受TNF调节。因此,IgCAM3决定了MLCK1在细胞内的定位,MLCK1是行使紧密连接通透性调节功能的主要分子。接着,研究者解析了MLCK1 IgCAM3结构域的晶体结构。通过计算机模拟和体外实验,从一个包含14000个化合物的文库中,成功筛选出一个可以特异性阻遏MLCK1转运、改善肠上皮屏障功能,但又不抑制MLCK激酶活性的小分子Divertin(图1)。

图1:Divertin阻遏MLCK1向PAMR转运
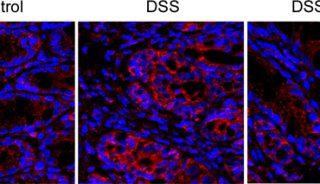
接下来,研究者在T细胞过继传输(CD4+CD45RBhiT cell adoptive transfer)诱导的结肠炎模型小鼠中检测了Divertin的治疗效果。发现Divertin能够在小鼠体内阻遏MLCK1向PAMR的转运,降低MLC磷酸化水平,改善肠上皮紧密连接通透性,减轻小鼠结肠炎症状,并且取得了比抗TNF治疗更好的效果(图2)。

图2:Divertin可减轻小鼠结肠炎症状,效果好于抗TNF治疗
综上,该研究发现一个特异性结合MLCK1 IgCMA3结构域的小分子Divertin,可阻遏MLCK1向PAMR转运,从而改善肠上皮屏障功能、治疗炎症性肠病。同时,该研究有助于开发非免疫抑制类型的新型炎症性肠病治疗药物。
据悉,该论文共同第一作者为芝加哥大学Vallen Graham,苏州大学剑桥-苏大基因组资源中心何伟奇,芝加哥大学Amanda Marchiando,以及苏州大学附属第一医院查娟民。通讯作者为芝加哥大学/哈佛大学医学院Jerrold R. Turner教授。何伟奇教授在南京大学模式动物研究所获得博士学位,主要从事肠黏膜屏障功能和肠上皮细胞分化研究;研究工作先后发表在Nature Medicine, Gastroenterology, Cellular and Molecular Gastroenterology and Hepatology,Journal of Biological Chemistry等杂志上。
参考文献
1. Odenwald, M.A. and J.R. Turner, Theintestinal epithelial barrier: a therapeutic target? Nat Rev Gastroenterol Hepatol, 2017. 14(1): p. 9-21.
2. Turner, J.R., Intestinal mucosal barrierfunction in health and disease. Nat Rev Immunol, 2009. 9(11): p. 799-809.
3. Cleynen, I. and S. Vermeire, Paradoxicalinflammation induced by anti-TNF agents in patients with IBD. Nat Rev Gastroenterol Hepatol, 2012. 9(9): p. 496-503.
4. Su, L., et al., TNFR2 activatesMLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrierloss and experimental colitis. Gastroenterology, 2013. 145(2): p. 407-15.
5. He, W.Q., et al., Myosin light chain kinaseis central to smooth muscle contraction and required for gastrointestinalmotility in mice. Gastroenterology, 2008. 135(2): p. 610-20.