生物物理所发现调控细胞迁移和巨胞饮作用的新分子
近期,中国科学院生物物理研究所研究员蔡华清课题组在Journal of Cell Biology上,发表题为Leep1 interacts with PIP3 and the Scar/WAVE complex to regulate cell migration and macropinocytosis的研究论文。该研究揭示了极性定位的信号蛋白Leep1通过协同调控磷脂酰肌醇三磷酸(PIP3)和肌动蛋白成核促进因子Scar/WAVE复合体,从而调节细胞伪足和巨胞饮结构形态建成的分子机制。
细胞极性是相关信号分子及其调控的生化过程在细胞特定区域选择性分布或激活的结果。极性需要在多种细胞过程中被建立和维持,细胞的极化状态也能根据微环境或细胞功能的变化而不断变化,构成细胞形态多样性和可塑性的基础。高度动态的细胞过程中(如细胞迁移和巨胞饮过程中)极性建立和维持的分子机制尚不明确。
课题组利用模式生物Dictyostelium discoideum细胞中极性分子响应均匀场趋化因子刺激产生瞬时转移定位的现象,采用比较蛋白质组学方法对趋化因子刺激不同时间点的外周膜蛋白组分进行系统分析,鉴定得到一个新的极性分子,命名为Leep1(Leading edge enriched protein 1)。研究证明,Leep1通过其N端非典型PH结构域与PIP3结合而特异定位于巨胞饮杯(macropinocytic cup)和迁移细胞的前导端。结合成像和生化实验,通过对leep1敲除和过表达细胞的表型分析,发现leep1敲除细胞表现出巨胞饮和伪足动态的缺陷,而leep1过表达在促进丝状伪足的同时竞争性抑制板状伪足和巨胞饮结构,也导致细胞定向运动和巨胞饮的缺陷。免疫共沉淀-质谱方法鉴定互作蛋白发现,Leep1特异结合Scar/WAVE复合体,并通过对Scar/WAVE复合体的负调控,影响微丝结构的重排,从而调节不同前端结构间的动态平衡和细胞功能。
该研究揭示了Leep1通过协同调控PIP3和Scar/WAVE复合体调节细胞伪足和巨胞饮结构形态建成的分子机制,为进一步研究细胞迁移和巨胞饮过程中极性建立和维持的机制奠定了基础。此外,该工作也为在其他细胞或生命过程中系统筛选极性调控元件提供了新的思路和手段。
蔡华清为论文通讯作者,生物物理所副研究员杨艺红和博士生李栋为论文并列第一作者。研究工作得到国家自然科学基金委、科学技术部和中科院战略性先导科技专项等的支持。
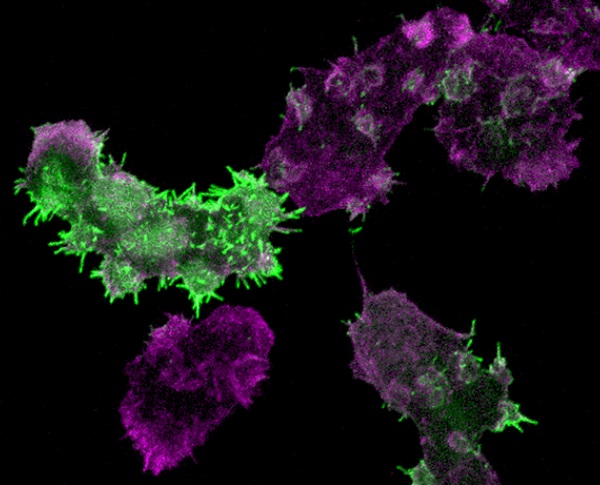
图1.Leep1过表达造成微丝骨架的异常(绿色荧光:GFP-Leep1,红色荧光:Alexa Fluor 555-labeled phalloidin标记的微丝骨架)
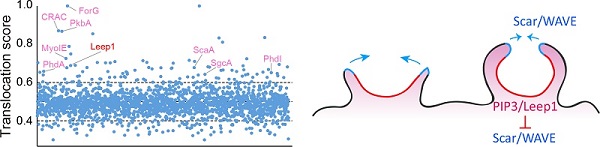
图2.Leep1协同PIP3和Scar/WAVE复合体调控细胞巨胞







