m6A调控肿瘤细胞上皮间质化 促进肿瘤EMT及侵袭转移
2019年5月6日,中山大学药学院王红胜团队在国际知名杂志Nature Communications期刊上发表题为“RNA m6A methylation regulates the epithelial mesenchymal transition of cancer cells and translation of Snail”的研究论文,发现肿瘤细胞上皮间质化(EMT)过程中mRNA的m6A显著上调,其可通过促进EMT关键转录因子Snail的翻译从而促进肿瘤EMT及侵袭转移。
EMT是上皮细胞获得间充质细胞特质的一种重要现象,即细胞获得具有纤维母细胞样的形态,增强的运动性,通过丢失黏附性和紧密连接,跨越基膜与邻近细胞进行交流。EMT的概念最初由胚胎学领域的发育生物学家提出,近年来已扩展到肿瘤的进展、侵袭和转移,被认为是肿瘤转移起始和关键步骤。其表型为上调间充质标志物,下调上皮标志物如E-Cadherin,使细胞从基底部脱落,细胞膜变得更具纺锤形表型和运动性,并获得细胞凋亡抵抗,其中转录因子Snail在其中发挥重要促进作用。近年来围绕EMT的表观遗传调控因素做了诸多研究,发现DNA甲基化及组蛋白修饰等均可参与肿瘤细胞EMT的发生发展,但mRNA修饰对肿瘤细胞EMT的影响尚未揭示。
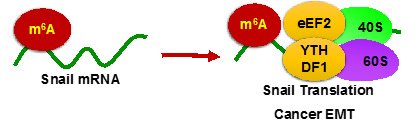
本研究发现,在肿瘤细胞EMT过程中,mRNAs的m6A修饰增加。甲基转移酶METTL3的缺失使得m6A水平下调,并抑制癌细胞在体外和体内的迁移、侵袭和EMT过程。m6A-seq和功能实验表明,EMT的关键转录因子Snail的表达受m6A调控,且过表达Snail能逆转METTL3缺失导致的细胞EMT抑制。进一步研究表明,SnailmRNA的CDS区而非3’UTR区的m6A修饰,可促进其mRNA的翻译延伸,其可能机制是通过YTHDF1与eEF-2的共结合促进多聚核糖体对其的翻译作用。体内实验表明METTL3敲除细胞株转移能力较野生型显著下调,过表达Snail则可在一定程度上逆转此现象。临床分析表明肝癌组织中Mettl3和YTHDF1表达高于癌旁组织,其上调是肝癌患者总体生存率(OS)不良预后因素。
-
项目成果
-
科技前沿

-
技术原理