北京大学Cell Res基因编辑研究新成果
来自北京大学的研究人员报告称,他们利用一种RNA导向的Cas9核酸酶在哺乳动物细胞和斑马鱼胚胎中有效实现了位点特异性基因编辑。相关论文“Genome editing with RNA-guided Cas9 nuclease in Zebrafish embryos”发表在3月26日的《细胞研究》(Cell Research)杂志上。
北京大学生物医学工程系席建忠(Jianzhong Jeff Xi)教授和分子医学研究所的熊敬维(Jing-Wei Xiong)教授为这篇论文的共同通讯作者。前者主要研究方向为生物传感器和生物芯片的开发;用于干细胞、癌细胞等代谢调控机制研究的新型功能材料设计和合成;以及心肌细胞动力学研究等方面。后者主要利用斑马鱼和小鼠作为遗传模式生物,研究心血管系统发育和再生的分子遗传机制。
2011年末,人工核酸酶介导的基因组编辑(genome editing with engineered nucleases)技术曾被《Nature Methods》杂志评为2011年度技术。理由是这种技术能通过在某些物种基因组中进行靶向特异性的突变,从而解答并提出更多精确的生物学问题。
经过基因工程改造的核酸酶主要包括:锌指核酸酶(zinc-finger nucleases,ZFNs)、转录激活因子样效应物核酸酶(transcription activator-like effector nucleases,TALENs)和归巢核酸内切酶(engineered meganucleases)。这些核酸酶已被成功地应用于哺乳动物细胞和包括果蝇、斑马鱼、青蛙、小鼠、大鼠和猪等在内的模式生物中。由于它们能够实现精确的基因组编辑,为基因功能研究、动植物基因组的改造以及疾病治疗创造了新的可能性。
近来科学家们在原核生物规律成簇的间隔短回文重复(Clustered regularly interspaced short palindromic repeats,CRISPRs)适应性免疫系统研究中取得了一些重要进展,由此为我们提供了另一种基因组编辑方法。根据位点结构和基因保守性,CRISPR被分为三个主要类型。内切核酸酶Cas9属于研究最深入的II型CRISPR/Cas系统。
Cas9酶与导向RNA协同作用定位在PAMs保守序列限定的位点,裂解入侵DNA。为了形成功能性的DNA靶向复合物,Cas9需要两种不同的 RNA转录物,crRNA(CRISPR RNA)和tracrRNA(transactivating crRNA)。然而,近期的研究表明,这样的双RNA可以重新装配成一种单导向RNA (single-guide RNA,sgRNA),其包含的序列足以编程Cas9,介导靶DNA双链断裂。
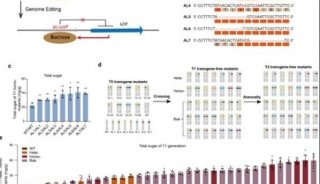
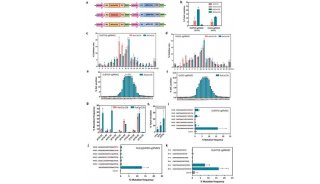
在这篇文章中,研究人员报告称,他们利用RNA导向的Cas9核酸酶在哺乳动物细胞和斑马鱼胚胎中,以一种简单且强有力的方式有效促进了基因组编辑。当研究人员用特异的Cas/gRNA靶向斑马鱼胚胎中的etsrp、gata4或gata5时,获得了超过35%的位点特异性突变。这一Cas9 /gRNA有效诱导了生成的体细胞中etsrp或gata5的双等位基因转换,在斑马鱼中导致了与对应遗传变异体etsrpy11或 fautm236a的相似表型。最后,他们通过Cas9/gRNA系统在斑马鱼胚胎中诱导获得了位点特异性的mloxP序列插入。
这些结果表明,这种Cas9/gRNA系统有潜力成为一种适用于斑马鱼和其他模式生物的,简单、强大且高效的反向遗传工具。结合其他的基因工程技术,这种Cas9系统有前景应用于生物、农业、环境研究及医学领域。