华人学者《ACS Nano》:用光杀死深部肿瘤
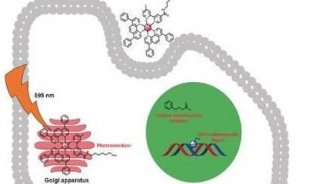
最近,由马萨诸塞大学医学院(UMMS)Gang Han博士带领的一个科学家小组,将一种新型纳米粒子与FDA批准的光动力疗法相结合,可在体内有效杀灭深部癌细胞,且对周围组织的伤害最小,比化疗具有更少的副作用。这种有前途的新疗法,可以将当前使用的光动力疗法扩展到更深部的恶性肿瘤。
本研究第一作者、UMMS生物化学和分子药理学助理教授Gang Han,早年毕业于南京大学,在马萨诸塞大学获博士学位,劳伦斯伯克利实验室博士后。他说:“我们非常兴奋地发现,使用我们增强型红光发射的纳米粒子与 FDA批准的光动力学疗法相结合,有望应用于临床实践,杀死更深部肿瘤中的恶性细胞。我们利用生物可相容的、低功率的、深组织渗透的980nm近红外光,做到了这一点。”
在光动力学疗法(也称为PDT)中,患者被给予一种无毒的光敏药物,其能够给所有人体细胞所吸收,包括肿瘤细胞。然后,专门调整药物分子的红色激光器,在肿瘤区域被选择性地打开。当红光与光敏药物相互作用时,它可产生一种高活性的氧(单线态氧),可杀死恶性肿瘤细胞,而使大部分邻近细胞不受伤害。
然而,由于红光穿透组织的能力有限,目前的光动力疗法仅用于皮肤癌或很浅组织的病变。如果能够到达更深处的癌细胞,就可以扩大光动力疗法的使用。
相关研究结果发表在最近的美国化学学会杂志《ACS Nano》,在这项研究中,Han及其同事们描述了一种新的策略,利用一类新的上转换纳米粒子(upconverting nanoparticles,UCNPs),其大小为十亿分之一米,可作为一种中继站。这些UCNPs与光动力学药物一起服用,将深穿透的近红外光转换成光动力疗法所需的可见红光,来激活抗癌药物。
为了实现这一光转换,Han及其同事们设计了一种UCNP,通过用氟化钙覆盖纳米粒子,使其在光谱的红色部分具有更好的排放,并利用镱来增强纳米粒子的涂覆。
在他们的实验中,研究人员使用低成本的、FDA批准的光敏剂药物——氨基乙酰丙酸,并将其与他们开发的、增广的、红光放射UCNPs相结合。然后,在肿瘤位置打开近红外光。Han及其同事发现,UCNPs可将近红外光成功地转换为红光,并在高于当前光动力疗法所获得的水平上,激活光动力药物。通过在体外和动物模型中进行的实验表明,这种联合疗法可利用较低的激光功率,更好地破坏肿瘤细胞。
新加坡国立大学特聘教授、上转换纳米粒子开发和应用带头人Yong Zhang,没有参与这项研究,但是他说,该研究小组通过成功设计放大这些纳米粒子中的红光放射,利用FDA批准的药物,制备了有史以来最深的光动力疗法。
Zhang说:“这种疗法,可作为深度超过1厘米恶性肿瘤(例如,乳腺癌、肺癌和结肠癌)的一种非侵入性杀手,具有很大的潜力,而且没有化疗的副作用。”
Han博士表示:“这种方法对癌症治疗是一个令人兴奋的新发展,既有效又无毒,它也为增广型红光放射纳米粒子在其他光激性和生物光子应用中的使用,开辟了新的机会。”
-
科技前沿
-
市场商机
-
焦点事件

-
项目成果