Nature Biotechnology:北大陈良怡提升荧光显微镜两倍分辨率
2014年诺贝尔化学奖授予了荧光超分辨显微技术,利用荧光分子的化学开关特性(PALM/FPALM/STORM)或者物理的直接受激辐射现象(STED),实现超越衍射极限的超分辨成像。尽管如此,活细胞中的超分辨率成像仍然存在两个主要瓶颈:
(1)超分辨率的光毒性限制了观察活细胞中精细生理过程;(2)受限于荧光分子单位时间内发出的光子数,时间和空间分辨率不可兼得。
受限于这个瓶颈,为了在活细胞上达到60nm空间分辨率极限,现有超分辨率成像手段需要强照明功率(kW~MW/mm2)、特殊荧光探针和长曝光时间(>2 s)。强照明功率引起的强漂白会破坏真实荧光结构的完整性,长曝光时间在图像重构时导致运动伪影,降低有效分辨率。迄今为止,基于光学硬件或者荧光探针的改进无法进一步提升活细胞超分辨率的时空分辨率,实现毫秒尺度60nm的时空分辨率成像。
2021年11月16日,北京大学未来技术学院陈良怡教授团队与哈尔滨工业大学仪器科学与工程学院李浩宇教授团队合作,在Nature Biotechnology(2020年IF54.908)上发表论文“Sparse deconvolution improves the resolution of live-cell super-resolution fluorescence microscopy”。他们另辟蹊径,发明基于新计算原理的荧光超分辨率显微成像,进一步拓展荧光显微镜的分辨率极限。通过提出“荧光图像的分辨率提高等价于图像的相对稀疏性增加”这个通用先验知识,结合之前提出的信号空时连续性先验知识,他们发明了两步迭代解卷积算法,即稀疏解卷积(Sparse deconvolution)方法,突破现有荧光显微系统的光学硬件限制,首次实现通用计算荧光超分辨率成像。结合自主研发的超分辨率结构光(SIM)系统,实现目前活细胞光学成像中最高空间分辨率(60nm)下,速度最快(564Hz)、成像时间最长(1小时以上)的超分辨成像。结合商业的转盘共聚焦结构光显微镜,实现四色、三维、长时间的活细胞超分辨成像。
1.应用举例:Sparse-SIM超快活细胞成像揭示核孔结构和胰岛素囊泡早期融合孔道
在活细胞成像中,稀疏结构光显微镜(Sparse-SIM)可以解析标记不同核孔蛋白(Nup35、 Nup93、Nup98或Nup107)的环状核孔结构,而它们在传统结构光显微镜(2D-SIM)下形状大小与100nm荧光珠类似(图1c,2d)。由于相机像素尺寸与孔径直径类似,测量的核孔拟合直径与Sparse-SIM的分辨率相当。校正后Nup35和Nup107孔的直径分别为~66±3 nm和~97±5 nm,而Nup98和Nup93直径大小处于这个范围中(图1e,1f),结果与以前用其他超分辨成像方法在固定细胞中获得的直径相符。有趣的是,12分钟超分辨成像可以显示活细胞中核孔形状变化,这可能反映了核膜上的单个核孔复合物动态重新定向到焦平面或远离焦平面(图1g),这是其他超分辨方法难以观察到的。
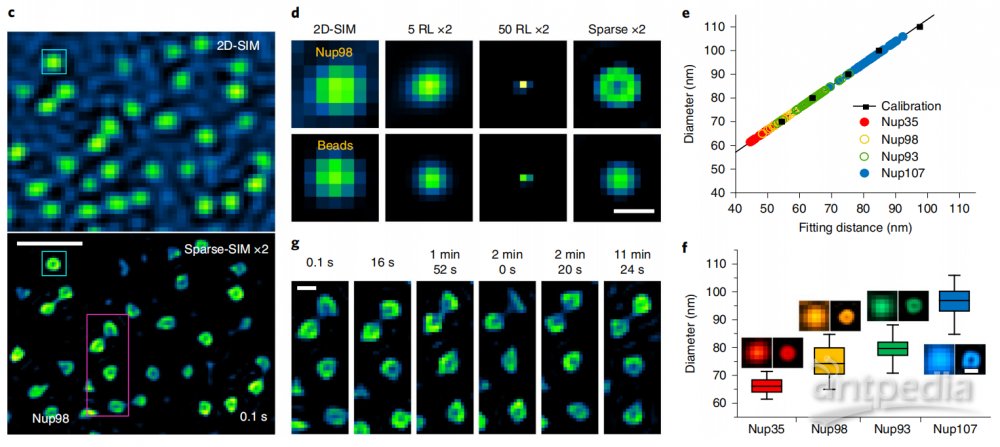
图1 Sparse-SIM解析核孔蛋白动态过程。(c)用Sparse-SIM观察活COS-7细胞中以Nup98-GFP标记的动态环状核孔的典型例子,持续时间超过10分钟。上下区域分别显示2D-SIM和Sparse-SIM下的图像。(d)比较(c)中青色框中的核孔结构快照与100 nm荧光珠在不同重建方法(2D-SIM、20次RL解卷积后、50次RL解卷积后、Sparse-SIM)下的结果。(e)矫正后得Nup35-GFP(红色)、Nup98-GFP(黄色)、Nup93-GFP(绿色)和Nup107-GFP(青色)标记的核孔结构的实际直径(详情请见文章)。(f)Nup35(66±3nm, n=30)、Nup98(75±6nm,n=40)、Nup93(79±4nm,n=40)、Nup107(97±5nm,n=40)的平均直径环。左右两幅蒙太奇分别为传统Wiener重构或稀疏解卷积后的结果。(g)在6个时间点对(c)中的品红色方框放大并显示。比例尺:(c)500nm;(d,g,f)100nm。
通过滚动重建,Sparse-SIM的时间分辨率可达564Hz,识别出来INS-1细胞中VAMP2-pHluorin标记的、更小的胰岛素囊泡融合孔道(如~61nm孔径,图2o,2p)。它们在囊泡融合的早期出现,孔径小(平均直径~87nm),持续时间短(9.5ms),不能被之前传统的TIRF-SIM所识别。另一方面,鉴别出来的稳定融合孔在囊泡融合的后期出现,孔径大(平均直径~116nm),持续时间长(47ms)(图2q),是之前看到的结构。值得一提的是,虽然这里发现的囊泡早期融合孔状态很难被其他的超分辨率成像手段所直接验证,但是它们的发生频率与30多年前用快速冷冻蚀刻电子显微镜所观察到的“小的融合孔发生概率远低于大的融合孔”现象相吻合。
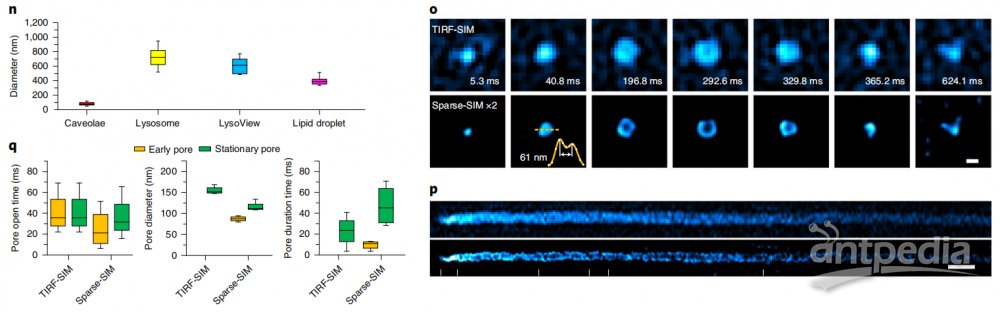
图2 Sparse-SIM解析超快胰岛素代谢过程。(n)不同种类囊泡的平均直径。(o)囊泡融合事件的代表性蒙太奇图像。(p)TIRF-SIM(上)和Sparse-SIM(下)记录的囊泡分泌Kymograph图。(q)早期(黄色)和稳定(绿色)融合孔的平均打开时间(左)、直径(中)和持续时间(右)。比例尺:【a,e,m(top)】5μm;(b,j)500nm;【h,m (bottom)】1μm;(k)100nm。
2.应用举例:稀疏解卷积是提升荧光显微镜分辨率的通用方法
与当下热门的深度学习超分辨率显微重建不同,信号的空时连续性、高空间分辨率导致的荧光图像相对稀疏性这两个先验知识,是荧光显微成像的通用先验知识,不依赖于样本的形态以及特定的荧光显微镜种类。因此,稀疏解卷积是通用荧光显微计算超分辨率成像算法,可被广泛应用于提升其他荧光显微模态分辨率,观察不同种类细胞器的精细结构及动态。
比如稀疏解卷积增强的商业超分辨转盘共焦结构光显微镜(SD-SIM),可以实现XY方向90纳米,Z方向250纳米的空间分辨率,清晰记录分裂期7μm深度内的全细胞内所有线粒体外膜网络(图3)。同样,若稀疏解卷积增强与商业SD-SIM结合,可以很容易实现活细胞上的三维、四色超分辨率成像。稀疏解卷积可以与膨胀显微镜结合,解析细胞膨胀后的复杂结构;也可以与宽场、点扫描的共聚焦、受激辐射损耗显微镜以及微型化双光子显微镜结合,实现近两倍的空间分辨率提升。因此,稀疏解卷积的提出,将帮助使用各种各样荧光显微镜的生物医学研究者更好地分辨细胞中的精细动态结构。
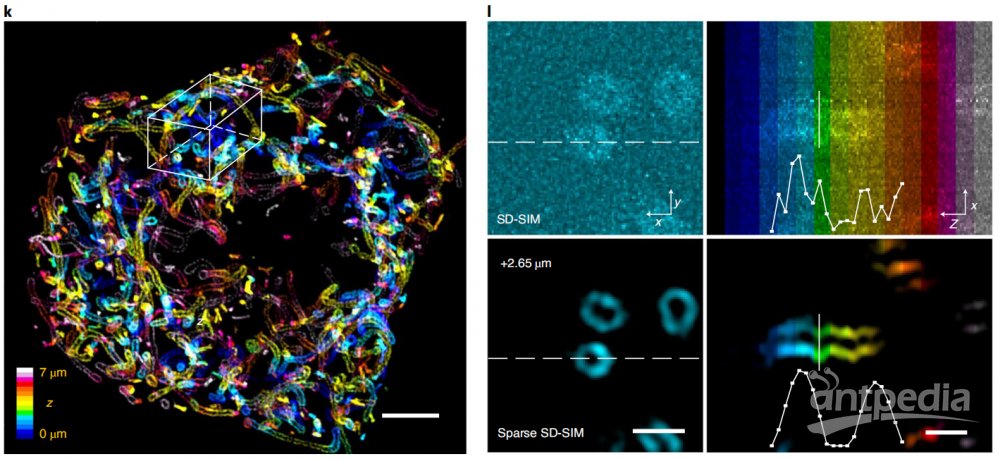
图3 Sparse SD-SIM解析活细胞三维线粒体外膜网络。(k)活体COS-7细胞的线粒体外膜(Tom20-mCherry标记)的三维分布,颜色表征深度。(l)SD-SIM原始数据与Sparse SD-SIM的水平(左)和垂直(右)的白色框区域放大展示。比例尺:(k)5μm;(l)1μm。
总之,通过稀疏解卷积算法(Sparse deconvolution)来实现计算荧光超分辨率成像,与目前基于特定物理原理或者特殊荧光探针的超分辨率方法都不相同。与超快结构光超分辨显微镜结合形成的Sparse-SIM是目前活细胞光学成像中,分辨率最高(60纳米)、速度最快(564帧/秒)、成像时间最长(1小时以上)的超分辨光学显微成像手段。它也可以与现有的多数商业荧光显微镜结合,有效提升它们的空间分辨率,看到更清楚的精细结构动态。
哈尔滨工业大学博士生赵唯淞、北京大学博士后赵士群、李柳菊为共同第一作者,李浩宇和陈良怡为论文共同通讯作者,共同作者还包括哈尔滨工业大学谭久彬院士、刘俭教授,北京大学毛珩博士、生科院成像平台单春燕博士和华南师范大学刘彦梅教授。参与合作的实验室包括武汉大学宋保亮教授、北京大学陈兴教授、中科院国家纳米科学中心丁宝全教授和生物物理所纪伟教授等。该项工作受到国家自然科学基金委重大研究计划、杰出青年基金,科技部重点研发专项,中国科协青年托举工程,黑龙江省自然科学基金优青,北京市科委、北京市自然基金委和北京大学博雅博士后计划等项目资助,得到北京大学膜生物学重点实验室、麦戈文脑研究所、北大-清华生命科学联合中心、北京智源人工智能研究院的支持,也是多模态跨尺度国家生物医学成像设施建设过程中的重要成果。
-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐
 询底价 Tel:400-6699-117 转 5224
询底价 Tel:400-6699-117 转 5224 -
项目成果

-
项目成果

-
精英视角

-
焦点事件

-
企业风采
-
焦点事件

-
项目成果
-
项目成果
-
项目成果