上海生科院发现胰岛素调控肝脏生物钟的分子机制
8月31日,国际学术期刊《自然-通讯》(Nature Communications)在线发表了中国科学院上海生命科学研究院营养科学研究所刘浥研究组的最新研究论文Insulin post-transcriptionally modulates Bmal1 protein to affect the hepatic circadian clock,该研究揭示了胰岛素通过调节生物钟核心转录因子Bmal1影响肝脏生物钟发生的分子机制。
生物节律 (circadian rhythm) 是普遍存在于生物体内的、以24小时为周期的、受调控的节律性的震荡。调控生物节律发生的机制被称为生物钟 (Circadian clock)。生物体的诸多生理活动,如睡眠、胰岛素的分泌、脂质生成、肝糖异生等,都是受生物钟调控的。近年来,越来越多的研究发现,生物钟对于维持机体代谢稳态具有至关重要的作用,生物钟紊乱是引发肥胖、糖尿病等代谢性疾病的重要因素之一。
在分子水平上,生物钟主要由正调控因子 Bmal1 和 Clock,以及负反馈因子Cryptochrome (Cry1,Cry2)、Period (Per1,Per2,Per3) 和 Rev-erbα 等所形成的两条正负反馈环组成。Bmal1 和 Clock 能够形成异源二聚体,结合在 Cry、Per 以及 Rev-erbα 等下游基因启动子区的 E-box (Enhancer box) 元件上,启动下游基因的转录。Cry 和 Per 能够形成异源复合体,进入细胞核,抑制 Bmal1 和 Clock 的转录活性,从而抑制其自身的表达,形成第一条负反馈环;Rev-erbα 结合在 Bmal1 启动子区的 RRE (Rev-erb/ROR response elements)元件上,抑制 Bmal1 的表达,形成第二条负反馈环;两条正负反馈通路,构成了分子生物钟的基本模型。
根据其存在部位的不同,生物钟分为两种:一种是存在于下丘脑视交叉上核的中心生物钟,又称主生物钟;另一种是存在于外周组织,如肝脏、肌肉等,称之为外周生物钟。外界光信号能够通过视网膜将信号传递至下丘脑,同步化中心生物钟,使得机体的生理行为与地球自转产生的昼夜节律相协调。外周生物钟除了受中心生物钟的调控之外,还受到一些其他因素的调控,如温度、饮食等。近年来研究发现,改变饮食能够重置外周生物钟,而对中心生物钟几乎没有影响。这表明饮食对于外周生物钟的调控是独立于中心生物钟的调控之外的,并且饮食对于外周生物钟的调控作用要大于中心生物钟的调控。尽管近年来对于阐明饮食与外周生物钟,特别是肝脏生物钟的关系,一直是该领域的研究热点,但是其分子机制目前仍不清楚。
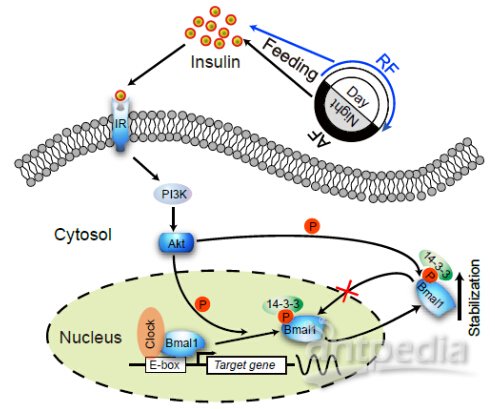
在刘浥指导下,博士生党法斌、孙秀杰等通过研究发现:在进食状态下,由胰腺分泌的胰岛素能够通过肝细胞表面的胰岛素受体,将信号传递至细胞内,激活 PI3K-AKT2 信号通路,激活的 AKT2 能够磷酸化 Bmal1-Ser42,被磷酸化的 Bmal1 与 14-3-3 结合,进而将 Bmal1 稳定在细胞质中,从而抑制 Bmal1/Clock 下游基因的表达。通过食物牵引试验(food entrainment)改变小鼠正常的饮食节律发现,一方面胰岛素分泌的节律会随之改变,导致 Bmal1 在细胞核内的聚集模式发生变化,Dbp, Rev-erbα 等下游节律基因的表达相位被逆转,表明肝脏生物钟的节律被重置;另一方面,小鼠通过增加饮食来储存食物,导致胰岛素分泌剧增,致使胰岛β-细胞遭受巨大的压力,这可能是造成胰岛β-细胞在饮食牵引状态下功能丧失的原因之一。这些发现不仅揭示了作为一种重要的进食信号,胰岛素调节肝脏生物钟发生的分子机制,也为理解不规律饮食与生物钟紊乱,及代谢综合征的发生之间的关系提供了新的启示。
该研究得到国家自然科学基金委、科技部、中科院等相关基金的支持。
胰岛素调控肝脏生物钟分子机制图
-
科技前沿
-
项目成果

-
项目成果