已找到反制办法!消除多种肿瘤对PD-L1抑制剂的耐药性
最近,加州大学旧金山分校的Robert Blelloch教授团队发现,肿瘤分泌的外泌体可能进入肿瘤引流淋巴结和脾脏中,抑制免疫细胞。他们还发现,抑制肿瘤外泌体的形成和释放,能消除多种肿瘤对PD-L1抑制剂的耐药性,并让免疫系统形成对该肿瘤的长期免疫记忆,使其充当了肿瘤疫苗。
此外,该研究还指出,在某些癌症中,将肿瘤组织中的PD-L1表达水平作为预测免疫治疗效果的标志物,是不准确的,而血液中的PD-L1水平也应当是一个需要考虑的因素。相关研究发表在顶级期刊《细胞》上,论文的第一作者是Mauro Poggio博士和Tianyi Hu博士[1]。

Robert Blelloch教授
从论文来看,Robert团队应当是在2018年那篇《自然》论文发表之前,就独立发现了肿瘤通过外泌体释放PD-L1压制全身免疫系统的现象,所以这篇文章将从发现之初开始讲起。
PD-(L)1抑制剂开启了癌症免疫治疗的新时代,但是其局限也同样为大家所熟知,那就是只有一小部分人(10%-30%)能从该疗法中获益[2]。为了解决这个问题,在进行免疫治疗前,人们通常会先对患者肿瘤组织的PD-L1表达水平进行检测,以便找出可能对免疫治疗获益的患者。
从原理上看,这个办法是行得通的,癌细胞利用PD-L1蛋白抑制免疫系统,那么PD-L1表达水平更高的肿瘤也应该更能响应免疫治疗,这在很多临床研究中也得到了证实。
不过,Robert团队在研究前列腺癌时,却发现了令人捉摸不透的现象。研究人员对癌细胞PD-L1的转录水平和蛋白水平进行检测发现,前列腺癌细胞PD-L1的mRNA水平足足是黑色素瘤细胞的15倍,经过一系列对mRNA翻译率的检测,研究者认为,相比黑色素瘤细胞,前列腺癌细胞应当是生产了更多的PD-L1蛋白的。
可奇怪的是,这两种癌细胞表面的PD-L1蛋白水平却是相当的。更奇怪的是,黑色素瘤能很好地响应PD-L1抑制剂,而前列腺癌却不行[3]。
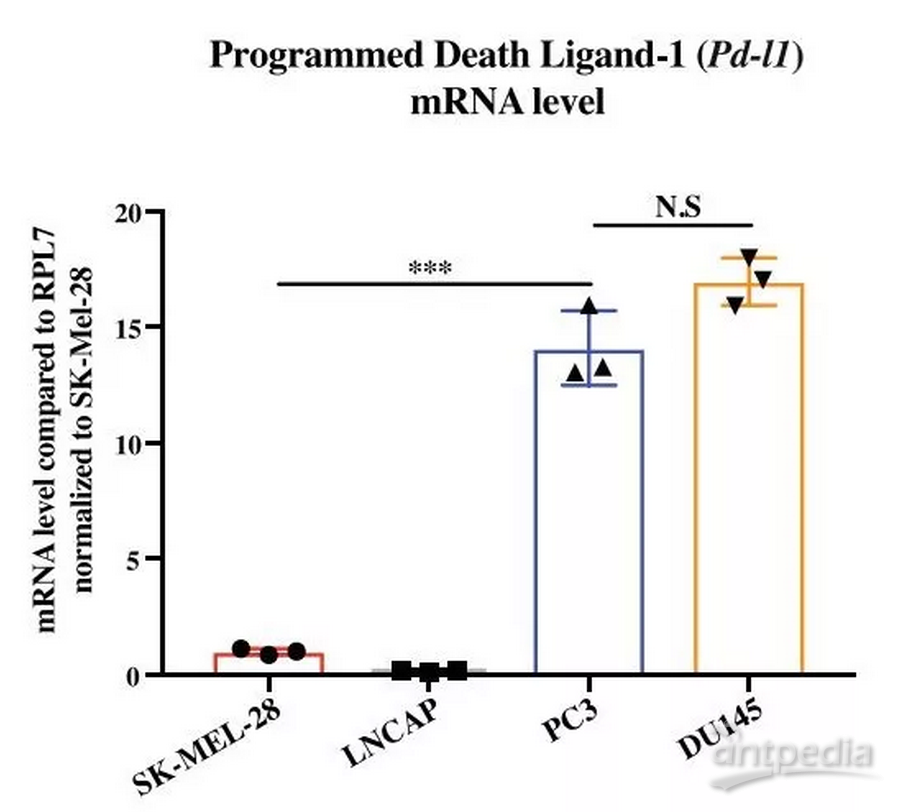
前列腺癌细胞的PD-L1mRNA的水平要高得多
Robert团队开始寻找前列腺癌细胞生产的巨量PD-L1蛋白的去处。 既然蛋白已经产生了,那它肯定不可能凭空消失。他们先是检测了细胞内的蛋白降解系统,并没有发现PD-L1被降解的线索。
那这些PD-L1蛋白到底去哪儿了呢?既不在细胞内,又没有被降解,那只能是被分泌到细胞外了。
于是,研究人员检测了前列腺癌细胞的胞外囊泡,终于找到了消失的PD-L1蛋白的踪迹。并且发现,这些PD-L1蛋白都是通过外泌体被释放的(外泌体是胞外囊泡的一种)。
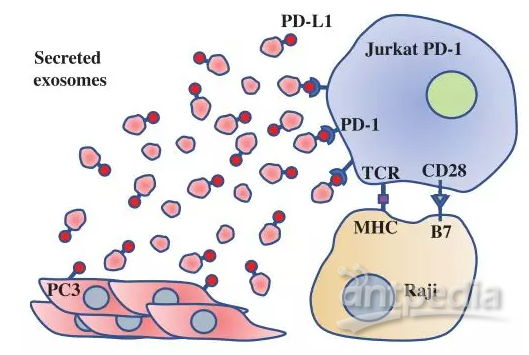
前列腺癌细胞释放含PD-L1蛋白的外泌体
肿瘤细胞通过外泌体释放PD-L1,自然不是为了干好事。
研究人员发现,这些外泌体中的PD-L1蛋白,在体外能够抑制T细胞的活化。他们在小鼠中也发现,这些外泌体在肿瘤引流淋巴结,这个免疫细胞阻击肿瘤细胞转移的前沿阵地,抑制T细胞的活化和增殖,推动肿瘤的进展。此外,脾脏中的免疫细胞也受到了影响。
发现了问题,就可能找到解决问题的办法。既然含PD-L1的外泌体对肿瘤的进展至关重要,那么外泌体也可能是其弱点。
外泌体的产生需要很多蛋白的帮助,包括一个叫NSMASE2的酶,负责的外泌体生成,和一个叫RAB27A的酶,参与外泌体的分泌过程[4,5]。
研究人员通过CRISPR技术,将前列腺癌细胞的NSMASE2、RAB27A或者PD-L1基因分别敲除,检测发现,这些癌细胞的增殖能力都没有受到影响,只是PD-L1或者外泌体被消除了。
将这些癌细胞注射到模型小鼠中,以正常的前列腺癌细胞作为对照。检测发现,对照组小鼠出现了明显的肿瘤生长。而PD-L1缺失或者不能分泌外泌体的癌细胞,并不能在小鼠中形成肿瘤,并且长期生存率远强于对照组。
以上实验说明,外泌体对前列腺癌的发展是至关重要的,而之前发现的前列腺癌对PD-L1抑制剂的抗性,可能可以通过抑制外泌体来解决。
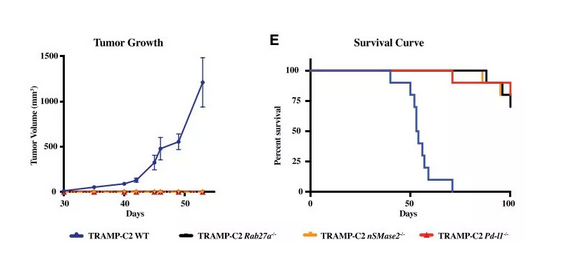
敲除外泌体能抑制前列腺癌的发展
不仅如此,当对这些曾经接种过缺陷癌细胞的小鼠,再注射正常癌细胞时,发现其也不能在小鼠体内形成肿瘤了,小鼠形成了全身性的免疫记忆,这些失去外泌体的癌细胞充当了肿瘤疫苗!
而这个发现的意义不止局限于前列腺癌,之前的研究发现,结直肠癌只能对PD-L1抑制剂有部分响应,研究人员推测外泌体在其中发挥了抗药作用。
于是,他们将癌细胞的外泌体分泌能力消除后,再用PD-L1抑制剂进行治疗,发现明显提升了用PD-L1抑制剂治疗的效果,部分解除了肿瘤的耐药性。当然,在结直肠癌中,敲除外泌体的作用不如前列腺癌好。
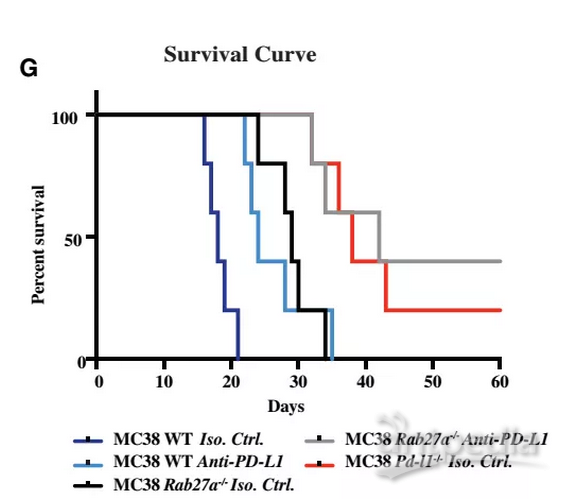
消除肿瘤细胞的外泌体,能增强PD-L1抑制剂的治疗效果
这项研究在多种肿瘤中证明,肿瘤会释放外泌体压制全身的免疫系统,促进肿瘤的进展,印证了之前的研究,并将指导人们继续探索其他类型的肿瘤,是否也能通过外泌体的释放来压制免疫系统。
并且,他们还找到了克制肿瘤分泌外泌体能力的靶点,证实抑制该靶点可以抑制外泌体的形成,克服PD-L1抑制剂的耐药性,并且还有助于机体形成肿瘤免疫记忆,这为提升免疫治疗效果开辟了新的道路。
此外,这个研究还指出,目前通过检测肿瘤组织PD-L1蛋白水平的方法,并不能作为准确的免疫治疗标志物,还需要考虑血液外泌体中PD-L1的水平,至少在前列腺癌中是这样。
参考资料:
[1] Mauro Poggio et al. Suppressionof Exosomal PD-L1 Induces Systemic Anti-tumor Immunity and Memory [J]. Cell, 2019,177,414–427. DOI.org/10.1016/j.cell.2019.02.016
[2] Page D B, Postow M A, Callahan M K, et al. Immune Modulation in Cancer with Antibodies[J]. Annual Review of Medicine, 2014, 65(1): 185-202.
[3] Sharma, P.,Hu-Lieskovan, S., Wargo, J.A., and Ribas, A.. Primary, adaptive, and acquired resistance to cancer immunotherapy [J]. Cell, 2017, 168, 707–723.
[4] Kosaka N, Iguchi H, Yoshioka Y, et al. Secretory mechanisms and intercellular transfer of microRNAs in living cells[J]. Journal of Biological Chemistry, 2010, 285(23): 17442-17452.
[5] Ostrowski M,Carmo N, Krumeich S, et al. Rab27a and Rab27b control different steps of theexosome secretion pathway[J]. Nature Cell Biology, 2010, 12(1): 19-30.







