研究揭示人类早期胚胎组蛋白修饰重编程
2019年7月4日,郑州大学孙莹璞课题组与清华大学颉伟课题组在Science上发表研究长文Resetting histone modifications during human parental-to-zygotic transition,揭示了人类早期发育过程中组蛋白修饰的重编程过程。
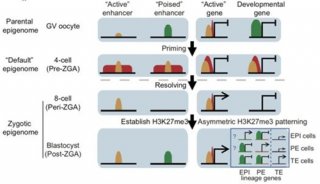
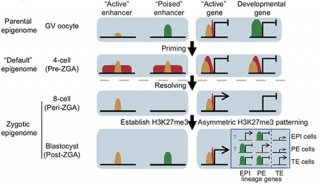
表观遗传学修饰参与基因表达调控并影响个体发育。在哺乳动物早期胚胎发育过程中,卵细胞受精形成具有全能性的受精卵,并经过细胞分裂与分化形成囊胚,后者包含具有多能性的内细胞团。伴随着发育的进行,表观遗传学修饰经历了剧烈的重编程。近年来,以小鼠等模式生物为研究模型,DNA甲基化、染色质开放性、染色质高级结构以及组蛋白修饰等表观遗传学特征的动态变化过程和规律都逐渐被揭示。在这项研究中,颉伟实验室利用并优化了蛋白与染色质结合位点检测的新技术CUT&RUN(Cleavage Under Targets and Release Using Nuclease ),成功地在少至50细胞的样品中实现了组蛋白修饰全基因分布的检测。在人类发育成熟的卵母细胞和早期胚胎中检测了H3K4me3,H3K27me3以及H3K27ac的动态变化。研究结果表明,人类早期胚胎发育过程中的组蛋白重编程经历了和小鼠非常不同的动态变化。前期研究表明,在小鼠中,H3K4me3与H3K27me3均呈现与体细胞不同的非经典的分布规律。而在人类卵细胞中,H3K4me3与H3K27me3均呈现经典的分布模式。在受精后,小鼠中母源H3K27me3能够传递至囊胚,而人类的H3K27me3在合子基因组激活前被大规模地去除,并在基因组激活后重新建立。H3K4me3在合子基因组激活前出现在许多启动子区域以及基因远端开放区域,并伴随着这些区域染色质开放性的建立。研究团队将这种H3K4me3称之为预备性的H3K4me3(priming H3K4me3)状态。在合子基因组激活后,这些区域会转变为激活或抑制的状态。研究人员提出了“表观基因组重启”模型。
这些结果揭示了人类早期发育中组蛋白修饰重编程的特殊性以及研究人类早期胚胎发育的重要性。同时,这些结果也为未来进一步理解人类早期胚胎的发育和临床指导提供了关键的数据和线索。